
Tepkime Hızları
Tepkime Hızı ve Çarpışma Teorisi
Kimya biliminde tepkime hızları, kimyasal tepkimelerin nasıl ve ne kadar hızlı gerçekleştiğini inceleyen önemli bir konu olan tepkime kinetiği alanında ele alınır. Tepkime hızı, birim zamanda madde miktarındaki değişimi ifade eder ve kimya özelinde bu tanım değişmez.
Bir kimyasal tepkimenin başlangıcında, giren maddelerin yoğunluğu yüksek olduğu için tepkime hızı hızlıdır. Ancak zaman içinde giren maddelerin yoğunluğu azaldıkça tepkime hızı yavaşlar.
Tepkime hızı genellikle “r,” “R,” veya “v” sembolleriyle gösterilir ve birim zamandaki madde değişimi olarak tanımlanır. Bu hızı ifade eden formül şu şekildedir:
v = Δm / Δt
Bu formülde, madde miktarı gram cinsinden ve zaman saniye cinsinden alındığında birimin birimi g/s (gram/saniye) olur.
Sabit hacimde gerçekleşen gaz tepkimelerinde ise hız, gazların kısmi basınçlarındaki değişime göre ifade edilir ve formül şu şekildedir:
v = ΔP / Δt
Bu durumda hızın birimi mol/L.s (mol/litre.saniye) olarak ifade edilir.
Unutulmaması gereken önemli bir nokta, hız formülleri yazılırken giren maddelerin derişiminin zamanla azaldığı için önüne “-” (eksi), ürünlerin derişiminin zamanla arttığı için ise önüne “+” (artı) işaretinin konulmasıdır.
Örnek
CH4+2O2→CO2+2H2O
Yukarıdaki CH4‘ün yanma tepkimesinde her bir molekülün kendisine ait hız denklemlerini yazmak istersek;
- VCH4= CH 4Derişimindeki Değişim / Geçen Süre = – Δ[CH4]Δt
- VO2= O 2Derişimindeki Değişim / Geçen Süre = – Δ[O2]Δt
- VCO2= CO 2Derişimindeki Değişim / Geçen Süre = + Δ[CO2]Δt
- VH2O= H 2O Derişimindeki Değişim / Geçen Süre = + Δ[H2O]Δt
Birim zamanda tepkimede 1 birim CH4
yakmak için 2 birim oksijen harcanacağı, 1 birim CO2
ve 2 birim H2
O üretileceği için bu hızlar arasındaki ilişki şu şekilde ifade edilebilir:
V[H2O]=2.V[CO2]=−1.V[O2]=−2.V[CH4]
Çarpışma Teorisi
Moleküler seviyede kimyasal tepkimeleri düşündüğümüzde, ürünlerin oluşabilmesi için giren moleküllerin (taneciklerin veya atomların) uygun açılarla çarpışmaları gerektiğini anlatan bir teoriye çarpışma teorisi denir. Bu teoriye göre:
- Taneciklerin çarpışması sırasında kimyasal bağlar kopar.
- Atom ya da atomların yapısında bulunan elektronlar yeniden düzenlenir.
- Yeniden düzenlenen elektron yapısı sayesinde yeni kimyasal bağlar oluşur.
Etkin Çarpışma:
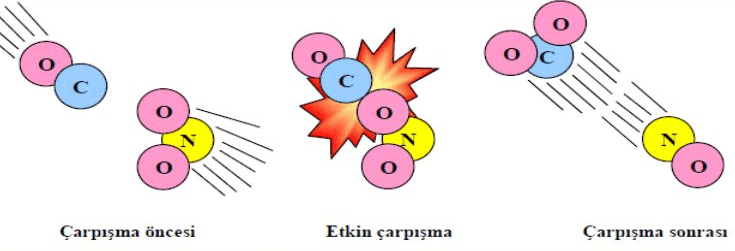
Bu teoriye göre her çarpışan taneciğin ürün oluşturabileceğini ifade ettik, ancak çarpışma teorisinin işleyebilmesi için taneciklerin etkin çarpışma yapması gereklidir. Etkin bir çarpışma gerçekleşebilmesi için:
- Taneciklerin yeterli kinetik enerjiye sahip olmaları gerekir.
- Taneciklerin bağları koparacak uygun geometrik açılarla çarpışmaları gerekir.
Herhangi bir tepkime için etkin çarpışma sayısı arttıkça tepkimenin hızlandığı sonucuna varabiliriz.
Ancak unutulmamalıdır ki etkin çarpışma yapmayan tanecikler, çok az miktarda ürün oluşturabilirler. Bu miktar genellikle ihmal edilebilecek kadar azdır. Örneğin, çoğu tepkime için ortalama etkin çarpışma sayısı yaklaşık olarak 10^17’dir. Yani yaklaşık olarak her 10^17 çarpışmadan bir tanesi sonucunda ürün oluşur.
Etkin Çarpışma
Aktifleşme Enerjisi
Kimyasal bir tepkimede ürünlerin oluşabilmesi için giren maddelerin etkin bir çarpışma yapmaları gerekmektedir. Bu etkin çarpışma için gerekli olan minimum enerji miktarına aktifleşme enerjisi denir ve genellikle Ea ile sembolize edilir.
Tepkimelerin hızı, aktifleşme enerjisinin miktarına bağlıdır. Yani, aktifleşme enerjisi yüksek olan tepkimeler daha yavaş gerçekleşirken, aktifleşme enerjisi düşük olan tepkimeler daha hızlı gerçekleşir. Bu nedenle, biyolojik tepkimelerin çoğu doğal olarak hızlandırmak için enzimler kullanılır. Aşağıdaki grafikte, enzimlerin kullanıldığı bir tepkimenin aktifleşme enerjisi değişimini görebilirsiniz.
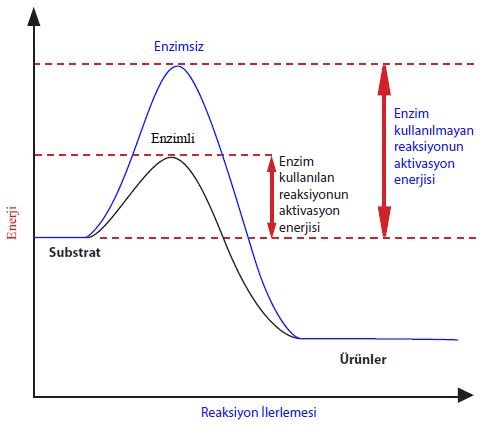
Önemli bir not olarak belirtmek gerekir ki aktifleşme enerjisi, sadece katalizörlerin (örneğin enzimlerin) etkisiyle değiştirilebilir. Enzimler doğal katalizörler olarak işlev görürler ve kimyasal tepkimeleri hızlandırırlar.
Aktifleşmiş Kompleks
Kimyasal bir tepkime enerji grafiği incelendiğinde, tepki başladığında enerji seviyesinin en yüksek olduğu noktaya aktifleşmiş kompleks denir. Aktifleşmiş kompleks, tepkime geçiş aşaması olarak kabul edilir ve bu aşamada içinde bulunan taneciklerin molekülleri ayrı ayrı gözlemlenemez, ancak tepkimenin bir geçiş aşaması olarak kabul edilir.
Aktifleşmiş kompleks içinde bulunan tanecikler yüksek enerjili ve kararsız bir yapıdadır. Bu nedenle, bu tanecikler potansiyel enerjilerini düşürerek daha kararlı bir duruma geçmeye çalışırlar. Aktifleşmiş kompleks içinde:
- Gerekli çarpışmayı ve elektron dizilimini sağlayan moleküller ürüne dönüşebilir.
- Gerekli çarpışmayı veya elektron dizilimini sağlayamayan moleküller ise tekrar eski hallerine dönebilir.
Tepkime Grafiğinden Entalpi Hesaplanması:
Enerji grafiği daha ayrıntılı bir şekilde incelendiğinde şu kavramlar ortaya çıkar:
- Kritik Nokta: Grafiğin en tepesinde bulunan kritik nokta, tepkimenin en kararsız olduğu noktadır.
- İleri Aktifleşme Enerjisi: Kritik noktaya ulaşmak için gereken enerji miktarıdır. Bu aynı zamanda tepkimenin başlaması gereken aktivasyon enerjisi olarak da adlandırılır.
- Geri Aktifleşme Enerjisi: Kritik noktadan sonra kaybedilen enerji miktarını ifade eder.
- Enzim: Tepkimenin aktivasyon enerjisini düşüren ve tepkimenin gerçekleşme süresini kısaltan kimyasal maddelerdir.
- Entalpi Değişimi: Geri Aktifleşme Enerjisi ile İleri Aktifleşme Enerjisi arasındaki farktır.
Önemli bir not olarak, tepkimelerin aktifleşme enerjisi büyüdükçe tepkimenin hızının azaldığını belirtmek gerekir.
Ekzotermik ve Endotermik Tepkimeler
Ekzotermik ve endotermik tepkimeler, gerçekleşebilmeleri için giren maddelerin çarpışma teorisine göre aktivasyon enerjisini aşacak yeterli enerjiye sahip olmaları gerekmektedir. Bu, çarpışma teorisine dayalıdır ve tepkimenin başlaması için belirli bir enerji eşiğini aşmayan taneciklerin tepkimenin başlamasına neden olamayacağını ifade eder.
- Endotermik Tepkimeler:
Endotermik tepkimeler, dışarıdan ısı enerjisi alarak gerçekleşirler. Bu tepkimelerin entalpi değişimi (ΔH) pozitif (+) işaretle gösterilir. Bu pozitif işaret, tepkimenin başlaması için giren maddelerin alması gereken ısı miktarını ifade eder.
Endotermik tepkimeler, dışarıdan ısı alması gerektiği için kendiliğinden devam etmezler. Sınır şartları altında istemli bir tepkime değildirler.
Endotermik tepkimelerde, giren maddelerin potansiyel enerji toplamı ürünlerin potansiyel enerji toplamından düşüktür. Bu nedenle, giren maddeler düşük sıcaklıkta, ürünler ise daha yüksek sıcaklıkta daha kararlıdır.
- Ekzotermik Tepkimeler:
Ekzotermik tepkimeler, gerçekleşirken çevreye ısı enerjisi verirler. Reaksiyon entalpi değişimi (ΔH) negatif (-) işaretle gösterilir. Bu negatif işaret, tepkime tamamlandığında çevreye verilen ısı miktarını ifade eder.
Ekzotermik tepkimeler, çevreye ısı verdiği için kendiliğinden devam edebilirler. Bu nedenle, sınır şartları altında istemli tepkimelerdir.
Ekzotermik tepkimelerde, ürünlerin potansiyel enerji toplamı giren maddelerin potansiyel enerji toplamından düşüktür. Bu nedenle, ürünler düşük sıcaklıkta, giren maddeler ise yüksek sıcaklıkta daha kararlıdır.
Tepkime Hızının Ölçülmesi ve Hız Denklemi
Tepkimenin hızı dışarıdan gözlemlediğimizde, belirgin fiziksel veya kimyasal özelliklerdeki değişikliklerle ölçülebilir. Bu değişiklikler arasında şunlar bulunabilir:
- Basınç değişimi
- Hacim değişimi
- Renk değişimi
- Derişim değişimi
- İletkenlik değişimi
- pH değeri değişimi
Örneğin, başlangıçtaki rengi bilinen bir tepkimenin rengindeki değişimi gözlemleyerek tepkimenin hızını ölçebiliriz. Aynı şekilde pH değişimi veya iletkenlik değişimi gibi diğer özellik değişikliklerini de gözlemleyerek tepkime hızını belirleyebiliriz.
Tepkime Hızı Denklemi
Tepkimenin hızını ifade etmek için tepkimeye giren maddelerin derişimlerine dayalı bir hız denklemi kullanılır. Hız denkleminde derişim terimi kullanıldığı için, katılar ve sıvılar gibi saf fazlar hız denkleminde yer almaz; yalnızca gazlar ve çözeltiler içinde bulunan giren maddeler hız denkleminde yer alır.
Orantı Sabiti (k)
Tepkimenin hızı, giren maddelerin derişiminin artmasıyla artar, çünkü bu etkin çarpışma sayısını artırır. Bu nedenle, giren maddelerin derişimleri ile tepkime hızı arasında bir oran vardır. Bu orana “orantı sabiti” denir ve genellikle “k” ile gösterilir. Her tepkime için özgü bir orantı sabiti vardır, yani her tepkime kendi orantı sabitine sahiptir.
Hız Denkleminin Yazılması
Hız denklemi, hız sabiti (k) ve tepken derişimleri tarafından yazılan bir hız yasasına dayanır. Hız denklemi mekanizmalı tepkimelerde ve ara basamaksız tepkimelerde farklı şekilde yazılabilir. Hız denklemi yazılırken aşağıdaki kurallara dikkat edilir:
- Hız denkleminde katıların ve sıvıların derişimi yer almaz.
- Hız denkleminde yalnızca gazların ve çözelti halinde bulunan maddelerin derişimi yazılır.
- Her hız denklemi, tepkimenin özgü bir hız sabiti (k) içerir.
- Hız sabiti (k), tepkimenin anlık sıcaklığına bağlıdır. Yani daha yüksek sıcaklıklarda gerçekleşen tepkimelerin k değeri daha yüksektir.
- Hız sabiti (k), tepkimenin anlık eşik enerjisine de bağlıdır. Eşik enerjisi ne kadar düşükse, k sabiti de o kadar yüksek olur ve tepkime hızlanır.
- Hız yasasında yer alan tepken derişimlerinin üst toplamına “tepkimenin derecesi” denir.
Örnek 1 – Homojen Bir Tepkimenin Hızının Yazılması
aA(g)+bB(g)→cC(g)+dD(g)
Örnek 2 – Heterojen Bir Tepkimenin Hızının Yazılması aA(g)+bB(k)→cC(g)+dD(g)
- Tepkimenin derecesi =a
- r = Tepkimenin hız denklemi =k.[A]a
- Eğera= 1 ise;
- k sabitinin birimi 1/s’dir
- r(tepkime hızının birimi) mol/L.s ‘dir.
- Eğera= 2 ise;
- k’nın birimi L/mol.s ‘dir
- r’nin birimi mol/L.s ‘dir
- Eğera= 3 ise;
- k’ nın birimi L 2/mol 2.s ‘dir
- r’nin birimi mol/L.s ‘dir
Örnek 3 aA(k)→cC(g)dD(g)
- Tepkimenin derecesi = 0
- r= Tepkimenin hız denklemi = k
Mekanizmalı Tepkimelerde Hız Denklemi
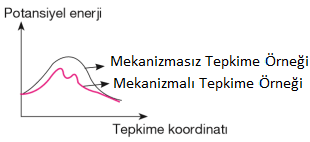
Gerçek hayatta, tepkimeler nadiren tek bir basamakta gerçekleşir. Tek basamakta gerçekleşmeyen tepkimelerde ara tepkime basamakları gözlemlenir. Ara tepkime basamakları gözlemlenen tepkimelere mekanizmalı tepkimeler denilir. Mekanizmalı tepkimelerde taraf tarafa toplama yapıldığında oluşan tek tepkimeye mekanizmalı tepkimenin genel tepkimesi denilir.
Mekanizmalı tepkimelerde hız denklemi yavaş basamağa göre yazılır.
Tepkime mekanizmasında üretilen ve sonrasında harcanan maddelere ara ürün denilir. Ara ürünler net tepkimede yer almaz.
Örnek bir mekanizmalı tepkime
NO(g) + Cl2(g) => NOCl2(g) (hızlı)
NOCl2(g) + NO(g) => 2NOCl(g) (yavaş)
—————————————————————
2 NO(g) + Cl2 => 2NOCl(g) (Net Tepkime)
Yukarıda örnek bir mekanizmalı tepkime verilmiştir. Bu verilen tepkime mekanizmasına göre şu verileri yorumlayabiliriz
- Tepkime hız denklemi = r = k . [NOCl2] . [NO]
- Tepkimenin derecesi = 1+1 = 2
- Ara ürün = NOCl2(g)
Homojen ve Heterojen Faz Tepkimeleri
Kimyasal tepkimeler, giren ve ürünlerin fiziksel hallerine göre homojen ve heterojen olarak sınıflandırılabilir. Eğer girenlerin ve ürünlerin hepsinin fiziksel halleri aynıysa homojen faz tepkimesi olarak adlandırılır. Eğer girenlerin ve ürünlerin fiziksel halleri farklıysa o tepkime heterojen faz tepkimesi olarak adlandırılır.
