
Atomun Kuantum Modeli
Atomun Kuantum Modeli
Atomun kuantum modeli, günümüz atom anlayışını yansıtan bir modeldir. Bu modele göre elektronların konumu ve vektörel hızı birbirini tamamlayan unsurlardır. Bu nedenle birini kesin olarak belirlediğimizde diğeri belirsizleşir. Yani bir elektronun kesin konumu ve hızı aynı anda bilinememektedir. Atomun kuantum modeline göre, elektronların çekirdek etrafındaki bulunma olasılığının en yüksek olduğu bölgeye “orbital” denir.
Elektronların dağılımı, bulundukları enerji düzeyinin türü ve sayısı tarafından belirlenir. Bu nedenle elektronların atom içinde hangi enerji seviyelerinde bulunduğunu belirlemek için kuantum sayılarına ihtiyaç vardır. Bu kuantum sayıları şunlardır:
- Baş kuantum sayısı (n),
- Açısal momentum (ikincil) kuantum sayısı (l),
- Manyetik kuantum sayısı (m),
- Spin kuantum sayısı (s)
I) Orbital
Avustralyalı fizikçi Schrödinger’a göre, atomdaki enerji düzeyleri ve dalga fonksiyonları kuantum sayıları ile ifade edilir ve kuantum mekaniğinde “orbital” terimi kullanılır.
II) Baş Kuantum Sayısı (n)
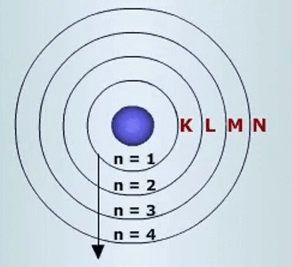
Baş kuantum sayısı, elektronun bulunduğu ana enerji seviyesini gösterir ve “n” ile gösterilir. Bu sayı, tam sayı değerlerini alabilir, örneğin 1, 2, 3, 4 gibi. Baş kuantum sayısı, elektronun çekirdeğe olan uzaklığı ile ilgilidir. Baş kuantum sayısı ne kadar küçükse, elektron çekirdeğe o kadar yakındır. Örneğin, bir elektron için n=2 ise, bu elektron 2. temel enerji seviyesindedir.
Ayrıca baş kuantum sayıları yerine “K (n=1), L (n=2), M (n=3), N (n=4), O (n=5)” gibi kabuk isimleri de kullanılabilir.
III) Açısal Kuantum Sayısı (l)
Açısal momentum kuantum sayısı (l), elektron bulutlarının şeklini ve bu farklı şekiller nedeniyle oluşan enerji seviyelerindeki değişiklikleri ifade eder. Açısal momentum kuantum sayısı “l” ile gösterilir ve n’ye bağlı olarak sıfırdan n-1’e kadar tamsayı değerlerini alabilir.
Örneğin, n = 3 ise, l = 0, 1, 2 gibi değerler alabilir.
Ana enerji seviyeleri, farklı alt enerji seviyelerini içerir, ve bu alt seviyelere ikincil katmanlar denir. İkincil katmanlar, s, p, d, f gibi harf sembolleriyle gösterilir (örneğin, s = sharp (keskin), p = principal (asıl, baş), d = diffuse (yayılmış), f = fundamental (temel)). Bu harf sembolleri, l kuantum sayısının farklı sayısal değerlerine karşılık gelir.
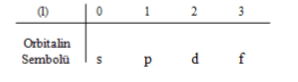
IV) Manyetik Kuantum Sayısı (ml)
Atomdaki alt enerji seviyeleri manyetik alanın etkisiyle birbirinden farklı orbitallere ayrılır. Manyetik kuantum sayısı, bu orbitallerin uzay içindeki yönelim biçimlerini ve alt enerji seviyelerinde bulunan orbital sayısını ifade eder.
Manyetik kuantum sayısı, ml ile gösterilir. Bu değer, açısal momentum kuantum sayısının bir fonksiyonu olarak belirlenir. Verilen bir l değeri için, ml değeri -l’den başlayarak 0’a kadar artan tam sayı değerlerini alır. Yani bu değerler, “-l, -l+1, -l+2, …, 0, 1, 2, …, l-1, l” gibi tam sayılardır.