Tepkimelerde Isı Değişimi Oluşum Entalpisi
Sistemlerin Sınıflandırılması
Sistem, incelenmek üzere seçilen sınırlı bir bölgeyi ifade eder. Sistemler, gözlem amaçlarına göre tanımlanır; örneğin, bir kozmolog için sistem, galaksileri içerebileceği gibi bir biyolog için sistem, bir hücre kadar küçük olabilir. Sistemlerin sınırları, yapılacak gözlem veya inceleme amacına göre belirlenir.
Çevre, ise sistemin dışında kalan evrenin diğer kısmını ifade eder. Başka bir deyişle, çevre, sistem içinde bulunduğu geniş ortamı temsil eder.
Evren, incelenen olayların gerçekleştiği sistem ile sistemin içinde bulunduğu çevreyi bir araya getirir. Evren, tüm inceleme ve gözlem süreçlerini kapsar.
Kimyasal olayların hemen hepsinde enerji değişimi gözlemlenebilir. Bu enerji, kinetik enerji, potansiyel enerji, ısı enerjisi gibi farklı türlerde olabilir ve bu enerji türleri birbirine dönüşebilir. Her tür enerji, kimyasal olarak iş yapabilme yeteneğine sahiptir. Kimyasal işlem, bir süreç boyunca gerçekleşen enerji değişimi olarak tanımlanır.
Kimyasal tepkimelerin büyük bir bölümünde, ısı enerjisinde bir değişim gözlenir. Bu konuyla ilgilenen bilim dalına termokimya denir.
Sistemlerin ve çevrenin arasında ısı alışverişi, madde alışverişi gibi faaliyetler gözlemlenebilir. Ayrıca, sistemlerin bazı özellikleri (örneğin sıcaklık, basınç, hacim gibi) belirli koşullarda sabit tutulabilir.
Sistemlerin Çevre ile İlişkisine Göre Sınıflandırılması
Sistemler, içinde bulundukları çevre ile madde ve enerji alışverişi durumuna göre üçe ayrılırlar.
Isı, Mekanik İş ve İç Enerji
Enerji, genellikle iş yapabilme kapasitesi olarak tanımlanır. Bu bağlamda, iş yapan bir sistemin iç enerjisi azalırken, iş alan bir sistemin iç enerjisi artar. Benzer şekilde, ısı veren bir sistemin iç enerjisi azalırken, ısı alan bir sistemin iç enerjisi artar.
Enerji Çeşitleri:
Kimyasal olayların hepsinde enerji değişimi gözlemlenebilir. Enerji, birden fazla çeşitten oluşur ve bu enerji türleri birbirine dönüşebilir. Her tür enerji, kimyasal olarak iş yapabilme yeteneğine sahiptir ve bu, bir süreçteki enerji değişimi olarak tanımlanır.
A) Kinetik Enerji:
Hareket eden bir cisim tarafından üretilen enerji türüdür. Kimyacılar için özellikle önemlidir ve kinetik enerji, bir cismin kütlesi (m) ve hızı (v) ile ilişkilidir.
Ke=m.v22
B) Potansiyel Enerji:
Bir cismin konumundan dolayı sahip olduğu enerji çeşididir. Bu enerji, genellikle depolanan enerji olarak tanımlanır. Örneğin, yüksekte bulunan bir taş parçasının enerjisi, konumuna göre daha alçak bir yerde bulunan başka bir taş parçasına göre daha büyük bir enerjiye sahiptir.
C) Kimyasal Enerji:
Kimyasal maddelerin yapısal birimleri içinde depolanan enerji çeşididir. Maddeler kimyasal tepkimelere girdiklerinde, kimyasal enerji serbest kalır, depolanır veya enerjinin başka bir formuna dönüşebilir.
D) İç Enerji:
Bir sistemi oluşturan atomlar, iyonlar ve moleküller gibi en küçük yapı taşlarının sahip olduğu tüm enerjilerin toplamına iç enerji denir. Bu nedenle iç enerji, bir sistemin içindeki tüm türlerin öteleme, dönme, titreşim, çekirdek enerjilerinin toplamını ifade eder. İç enerji, sembolü U ile gösterilir ve iç enerji değişimi ΔU olarak simgelenir.
ΔU=Uson–Uilk
şeklinde hesaplanır. İç enerji bir hal fonksiyonudur. Yani iç enerjinin tam değeri ölçülemez sadece iç enerji değişim miktarı ölçülebilir. Yalnızca ısı (Q) ve iş (W) alışverişinin olduğu bir sistemde iç enerji değişimi
ΔU=ΔQ+ΔW
olarak ifade edilebilir.
-
- Çevrenin sisteme karşı iş yaptığı durumlarda mekanik iş pozitiftir “w = +”.
Isı ve Mekanik İş İlişkisi
Fizikte iş, genellikle kuvvet ve uzaklığın çarpımı olarak tanımlanır. Ancak, termodinamikte işin tanımı biraz farklılık gösterir. Termodinamik bağlamda iş, mekanik iş, elektriksel iş ve benzeri kavramları içeren geniş bir anlam taşır. Kimyasal tepkimelerle ilgili en yaygın olanı ise gazların genleşmesi ve sıkışmasından kaynaklanan basınç-hacim işidir.
Şöyle düşünelim: Belirli bir sıcaklık, basınç ve hacimde, ağırlıksız, sürtünmesiz hareket edebilen bir pistonla bağlantılı bir silindir içindeki bir gazı ele alalım. Gaz genleştiğinde, sabit bir dış atmosfer basıncına (P) karşı piston yukarı doğru itilir ve gaz tarafından çevreye yapılan iş w = -P * ∆V olarak ifade edilir.
Burada ∆V, hacimdeki değişimi (Vs – Vi) temsil eder.
Gaz genleştiğinde (∆V > 0), yapılan iş negatiftir, yani sistem iç enerjisini iş yapmak için harcamıştır.
Gaz sıkıştırıldığında (∆V < 0), yapılan iş pozitif bir büyüklüğe sahiptir, yani sistem iç enerjisini artırmıştır.
Bir gazla yapılan veya bir gaz tarafından yapılan işin birimi litre atmosferdir (L atm). İşin SI birimi ise Joule (J)’dir.
1 L atm =101,3 J
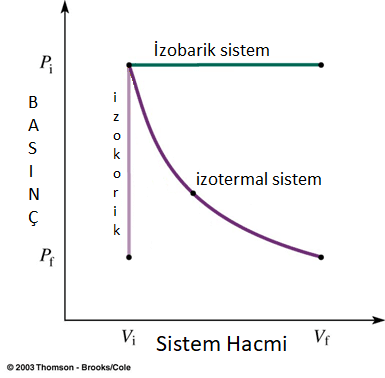
A) Sabit Hacimli Sistemlerde İç Enerji Değişimi
Sabit hacimli (izokorik) sistemlerde mekanik iş gözlemlenmez ve iç enerji değişimi, ısı enerjisi değişim miktarı kadar olur.
ΔU = ΔQ
B) Sabit Basınçlı Sistemlerde İç Enerji Değişimi
Sabit basınçlı (izobarik) sistemlerde (hareketli pistonlu sistemler), hem mekanik iş hem de ısı enerjisi değişimi gözlemlenir. Bu nedenle iç enerji değişimi aşağıdaki gibi hesaplanır:
ΔU = ΔW + ΔQ = ΔQ – (P * ΔV)
İç Enerji ile Entalpi Hesaplanması
Sabit basınç altında gerçekleşen kimyasal tepkimelerde sistem, ısısal işin yanı sıra mekanik iş de yapar. Bu nedenle entalpi hesabında mekanik işe de yer verilmelidir.
H = U + P * V
Burada:
- U: Sistemin iç enerjisi
- P: Sistemin basıncı
- V: Sistemin hacmi
Ancak sistemin iç enerjisini tam olarak ölçemediğimiz için iç enerji değişimini ölçebildiğimiz bir değere dönüştürmek gerekir.
ΔH = ΔU + Δ(P * V)
Eğer sistem sabit basınç altındaysa, yukarıdaki denklem aşağıdaki gibi ifade edilebilir:
ΔH = ΔU + P * ΔV
Bu, entalpi değişiminin iç enerji değişimi ve basınç ile hacim değişiminin bir fonksiyonu olduğunu gösterir.
ΔH=ΔU+P.ΔV
Termodinamik Yasaları ve Sonuçları
Sıcaklık, bir maddenin oluşturan taneciklerin ortalama kinetik enerjisini ifade eder. Isı ise sıcaklık farkından kaynaklanan iki madde arasında transfer edilen enerjinin adıdır. Sıcaklık, kendisi bir enerji değil, maddenin içkin bir özelliğidir. İki farklı sıcaklığa sahip iki madde arasında ısı transferi gerçekleşir ve bu transfer, iki maddenin sıcaklıkları eşitlenene kadar devam eder.
I) Isı ve Sıcaklık Kavramları

Sıcaklık, bir termometre ile ölçülür ve genellikle belirli bir ölçüm birimine sahiptir. Isının birimi ise joule veya kalori (cal) olarak ifade edilir. Bir madde tarafından emilen veya yayılan toplam ısı doğrudan bir ölçüm cihazıyla ölçülemez; ancak matematiksel olarak hesaplanabilir.
Q = m * c * Δt = m * c * (t2 – t1)
Burada:
- Q: Aktarılan ısı miktarı
- m: Maddesinin kütlesi
- c: Maddesinin öz ısısı
- Δt: Maddesinin sıcaklık değişimi
- t2: Maddesinin son durumdaki sıcaklığı
- t1: Maddesinin ilk durumdaki sıcaklığı
Bu denklem, ısı transferinin miktarını hesaplarken kullanılır ve bir madde üzerindeki sıcaklık değişimine bağlı olarak ne kadar ısı aktarıldığını belirlememize yardımcı olur.
II) Termodinamik Yasaları
A) Termodinamiğin Sıfırıncı Yasası
Termodinamiğin sıfırıncı yasası, şöyle ifade edilir: “Eğer iki farklı madde üçüncü bir madde ile termal denge içindeyse, bu iki madde de birbiri ile termal denge içindedir.” Bu durumda, aralarında ısı alışverişi olmaz ve sıcaklıkları eşittir. Sıfırıncı yasa, termodinamik denge ve sıcaklık ölçümü gibi konuların temelini oluşturur. Termometreler, sıfırıncı yasa sayesinde çalışır; çünkü termometreler bulundukları sistem ile termal denge içindedir ve bu nedenle sistemin sıcaklığını doğru bir şekilde ölçebilirler.
B) Termodinamiğin Birinci Yasası
Termodinamiğin birinci yasası, enerjinin korunumu ilkesini ifade eder. Bu yasa, enerjinin ne yaratılabileceğini ne de yok edilebileceğini belirtir; sadece bir enerji formundan diğerine dönüşebileceğini gösterir. Yani toplam enerji miktarı sabittir. Termodinamiğin birinci yasasının bir sonucu olarak, bir sistem ile çevresi arasındaki enerji değişimi toplamı sıfırdır. Çünkü enerji yoktan yaratılamaz veya yok edilemez, sadece bir yerden başka bir yere aktarılabilir veya bir enerji formundan diğerine dönüştürülebilir. Bu yasa, enerji korunumu ilkesini temsil eder ve şu şekilde ifade edilebilir:
ΔU = Q – W
Burada:
- ΔU: Sistemdeki iç enerji değişimi
- Q: Sistem ile çevre arasındaki ısı transferi
- W: Sistem tarafından yapılan iş
Bu denklem, enerji değişiminin korunumu prensibini yansıtır ve enerjinin iş ve ısı olarak iki farklı şekilde transfer edilebileceğini gösterir.
çΔUsistem+ΔUçevre=0
ΔUsistem=ΔQ+ΔW=ΔUson–ΔUilk
C) Termodinamiğin İkinci Yasası
Termodinamiğin ikinci yasası, istemli olaylar ve entropi (düzensizlik) ile ilgilenir. Bu yasa, evrenin entropisinin düzenli olaylarda arttığını ve denge halindeki bir olayda sabit kaldığını belirtir.
Termodinamiğin ikinci yasası şu şekilde ifade edilir: “Her istemli olayda evrenin toplam entropisi artar ve evren zaman içinde bir dengeye yaklaşır.”
İstemli olaylar, kendiliğinden gerçekleşen olaylardır, ve entropi düzensizliği temsil eder. Entropi, katı maddelerde daha azken, sıvılarda katılara göre daha fazladır. Sistem ve çevrenin entropisi şu şekilde ifade edilir:
ΔS_evren = ΔS_sistem + ΔS_çevre
D) Termodinamiğin Üçüncü Yasası
Termodinamiğin üçüncü yasası, mutlak sıfır derecede (0 Kelvin) sıcaklıkta kusursuz bir kristalin mutlak entropisinin sıfır olduğunu belirtir.
Termodinamiğin ikinci yasası ile üçüncü yasa arasındaki fark şudur: İkinci yasa, entropi değişimini istemli olaylarla ilişkilendirerek açıklar, ancak üçüncü yasa, mutlak sıfır derece sıcaklıkta entropiyi doğrudan ölçme üzerine odaklanır. Üçüncü yasa, sıcaklığın mutlak sıfırda sıfır olduğunu ve entropinin bu koşulda sıfır olduğunu gösterir.
Entalpi ve Entalpinin Hesaplanması
Entalpi ve Tepkimelerin Sınıflandırılması
Entalpi, bir maddenin yapısında depolanan tüm enerjilerin toplamını temsil eder ve genellikle “H” ile gösterilir. Bir maddenin entalpisi tam olarak ölçülemez; ancak entalpi değişimi (ΔH) belirli bir değere sahiptir. Entalpi değişiminin hesaplanması için birçok yöntem vardır.
Endotermik ve Ekzotermik Tepkimeler
Kimyasal tepkimeler, endotermik ve ekzotermik tepkimeler olmak üzere iki ana kategoriye ayrılır.
- Endotermik Tepkimeler: Endotermik tepkimeler, tepkimeye giren maddelerin (standart veya molar) oluşum entalpileri toplamının, ürünlerin (standart veya molar) oluşum entalpileri toplamından küçük olduğu durumlardır. Yani bu tepkimelerin gerçekleşmesi için dışarıdan ısı alması gerekmektedir. Endotermik tepkimelerin entalpisi (ΔH) pozitif işarete sahiptir. Bu tür tepkimeler dışarıdan ısı almak zorunda oldukları için kendiliğinden devam etmezler ve istemli tepkimeler değildirler.
- Ekzotermik Tepkimeler: Ekzotermik tepkimeler, ürünlerin (standart veya molar) oluşum entalpileri toplamının girenlerin (standart veya molar) oluşum entalpileri toplamından küçük olduğu durumlardır. Bu tepkimeler sırasında çevreye ısı verilir. Reaksiyon entalpisi değişimi (ΔH) negatif işarete sahiptir. Ekzotermik tepkimeler, çevreye ısı verdikleri için tepkime bittikten sonra kendiliğinden devam edebilirler ve istemli tepkimelerdir.
Bu iki kavram, kimyasal tepkimelerin enerji değişimini ve termal davranışını açıklamak için önemlidir.
Standart Oluşum Entalpisi Yöntemiyle Entalpi Hesabı
Bir maddenin ΔH değeri, genellikle elementlerinden sentezlenen tepkimeler üzerinden hesaplanır. Bir bileşiğin elementlerinden oluşması sırasındaki entalpi değişimine “oluşum entalpisi” denir ve ΔHf ile gösterilir. Elementlerin en kararlı doğal hallerindeki standart oluşum entalpileri sıfır kabul edilir.
Bir bileşiğin 1 molünün standart şartlarda (1 atm ve 25 °C) elementlerinden oluşması sırasındaki entalpi değişimine “standart molar oluşum entalpisi” denir ve ΔH°f ile gösterilir.
Bir tepkimenin entalpi değişimi, ürünlerin standart oluşum entalpileri toplamından, girenlerin standart oluşum entalpileri toplamını çıkararak hesaplanabilir.
ΔH°=∑ΔH°f(ürünler)–∑ΔH°f
(girenler)
Entalpi Diyagramları Yardımıyla Entalpi Hesabı
Entalpi Değişimi ve Entalpi Diyagramları
Bir tepkimenin entalpi değişimlerini görsel olarak temsil eden şemalara “entalpi diagramı” denir. Entalpi diagramlarında genellikle “Girenler” ve “Ürünler” arasındaki entalpi değerleri bulunur. Bu değerler kullanılarak tepkimenin entalpi değişimi hesaplanır. İki tür entalpi diyagramı vardır:
1) Basitleştirilmiş Entalpi Diyagramları:
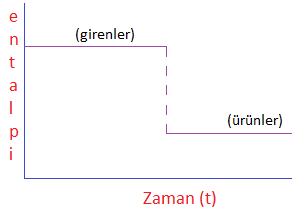
Basitleştirilmiş entalpi diyagramlarında, sadece girenlerin ve ürünlerin entalpi değerleri gösterilir. Ürünlerin entalpi değeri, girenlerin entalpi değerinden çıkarıldığında entalpi değişimi elde edilir. Eğer entalpi değişimi negatifse, tepkime ekzotermiktir (ısı veren tepkime); eğer entalpi değişimi pozitifse, tepkime endotermiktir (ısı alan tepkime).
2) Bilimsel Entalpi Diyagramları:
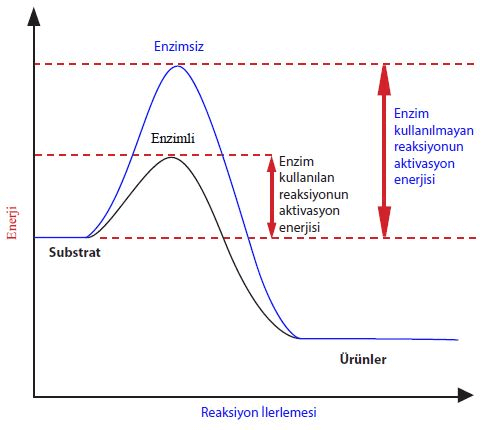
Bilimsel entalpi diagramları daha detaylıdır ve aşağıdaki kavramları içerir:
- Kritik Nokta: Grafikteki en yüksek nokta kritik noktadır. Kritik noktadaki bir tepkime en kararsız durumdadır.
- İleri Aktivasyon Enerjisi: Kritik noktaya ulaşmak için gerekli olan enerji miktarını ifade eder. Reaksiyonun başlaması için bu enerjiye ihtiyaç vardır ve aktivasyon enerjisi olarak da bilinir.
- Geri Aktivasyon Enerjisi: Kritik noktadan sonraki enerji kaybını gösterir.
- Enzim: Tepkimenin aktivasyon enerjisini düşüren ve tepkimenin hızını artıran kimyasal maddelerdir.
- Entalpi Değişimi: Geri Aktivasyon Enerjisi – İleri Aktivasyon Enerjisi şeklinde hesaplanır.
Bu bilimsel entalpi diagramları, tepkimelerin detaylı analizini yapmak ve tepkimelerin hızını etkileyen faktörleri incelemek için kullanılır.