Kimya Bilimi
Bilim Olarak Kimya: Giriş
Kimya, maddenin yapısını, özelliklerini, birleşimini, maddeler arası etkileşimleri ve tepkimeleri üzerinde araştırma ve uygulama yapan bir bilim dalıdır. Kimyada maddenin temel birimi olan atom ve atoma bağlı kavramlar sıkça kullanılır.
I) Kimyanın Tarihsel Gelişimi
Kimya bilimi tarihsel açıdan incelendiğinde; simya öncesi, simya dönemi, geleneksel kimya ve modern kimya olmak üzere dört ana kısma ayrılabilir.
A) Simya Öncesi Dönem
Bu dönem Antik Mısır’la başlamıştır. Bazı uygarlıklar, günlük hayatta sıkça kullanılan metalleri tanımlayarak bu metaller için semboller geliştirmişlerdir.
B) Simya Dönemi
Simya dönemi, binlerce yıl öncesinden 17. yüzyıla kadar uzanan bir süreci kapsar. Bu dönemde simyacılar, ucuz metalleri altına dönüştürmeyi amaçlayan felsefe taşını üretmeye ve ölümsüzlüğü sağlayacak bir iksir bulmaya çalıştılar. Ancak simya, bilimsel bir yöntemle değil, daha çok deneme-yanılma yöntemiyle ve rastlantısal keşiflere dayanarak yapılan çalışmalarla bilim olarak kabul edilmez. Yine de simyacılar, kimyanın temel altyapısını oluşturarak kimya biliminin gelişimine katkıda bulunmuşlardır. Simya dönemi, Robert Boyle’ün 1661’de yayınladığı “The Sceptical Chymist” eserinden sonra sona erdi.
C) Geleneksel Kimya
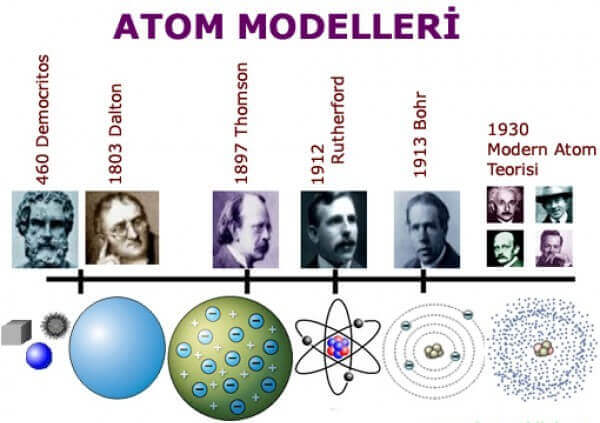
Geleneksel kimya dönemi, 17. yüzyılın sonları ile 19. yüzyılın ortaları arasında gerçekleşmiştir. Bu dönemde, Johann J. Beecher’ın yanma ile ilgili filojiston kavramı, Coulomb’un benzer yüklü maddelerin birbirini ittiği, karşıt yüklü maddelerin birbirini çektiği ve bu kuvvetin hesabını içeren Coulomb Yasası gibi önemli olaylar yaşanmıştır. Ayrıca, John Dalton tarafından sunulan atom teorisi, modern kimyanın temellerini atmıştır.
D) Modern Kimya
Modern kimya, 19. yüzyılda başlamış ve günümüze kadar devam etmiştir. Bu dönemde gerçekleşen bazı önemli gelişmeler şu şekildedir:
- William Crookes, atom teorisinde ilerlemeler kaydetmiştir.
- Eugene Goldstein, protonun varlığını ispatlamıştır.
- Wilhelm Roentgen, katot ışınlarının ürettiği ışıltıyı araştırırken kazara x-ışınını keşfetmiştir.
- J.J. Thomson, kendi atom modelini geliştirmiş ve 1906 Nobel Fizik Ödülünü almıştır.
- Dmitri Mendeleev, 1869 yılında bir eserinde periyodik tabloyu yayınlamıştır.
- Marie Curie, radyoaktiviteyi keşfetmiş ve Polonyum ile Radyumu izole etmiştir.
- Ernest Rutherford, alfa parçacığı, beta parçacığı ve gama ışınını keşfetmiştir.
II) Kimya Ne İşe Yarar?
Kimya, elementleri ve bu elementlerin oluşturduğu yapıları tanıtarak bu yapılar arasındaki ilişkileri inceler ve yorumlar. Kimya sayesinde olayların nasıl gerçekleştiğini, tepkimelerin nasıl oluştuğunu anlayabiliriz. Ayrıca, hangi şartlarda hangi maddelerin nasıl tepkime verebileceğini, yeni maddelerin nasıl üretilebileceğini öğreniriz.
Kimya, günlük hayatımızda birçok işi daha pratik bir şekilde yapmamıza olanak tanır. Örneğin, şekerin çayda nasıl daha hızlı karıştığını bilmek gibi basit bilgiler, kimya sayesinde elde edilir.
Aynı zamanda, kimya sorgulamayı, deneylerle başkasının fikirlerini test etmeyi öğretir ve kendi dilimizde ifade edebildiğimiz tepkimeleri evrensel bir kimya diliyle diğerleriyle paylaşmamıza olanak tanır.
III) Evrensel Kimya Dili
Her bilim dalında olduğu gibi, kimyada da kendi özel gösterim biçimleri vardır. Öncelikle kimyasal kavramları tanıyalım.
Madde ya da özdek, uzayda yer kaplayan (hacim), kütlesi olan tanecikli yapılara denir. Maddenin en küçük yapı birimi atomlardır. Atomlar birleşerek maddeleri meydana getirir. Atomlar elektron, nötron ve protonlardan oluşmuştur.
Maddenin bileşimini değiştirmeyen ancak fiziksel yapısını değiştiren etkenlere fiziksel değişim, maddenin bileşimini değiştiren etkenlere ise kimyasal değişim denir.
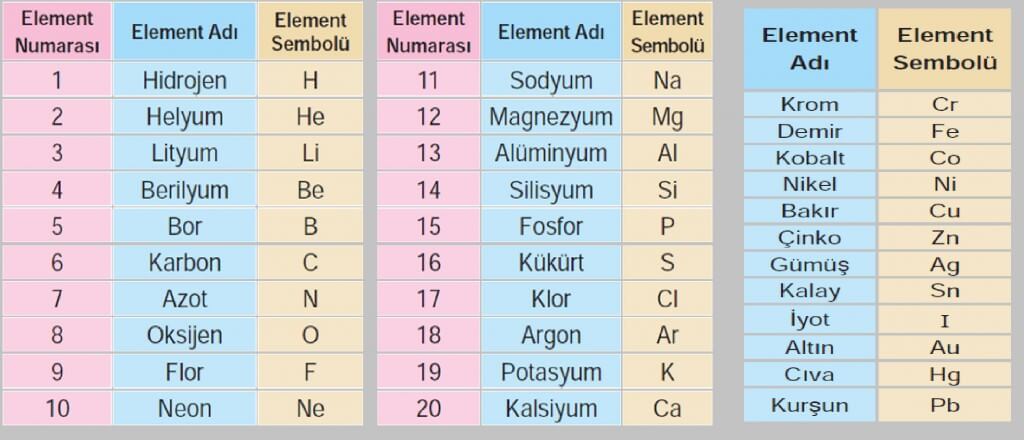
Kimya biliminde elementler, kendilerine özel bazı harflerle gösterilir. Örneğin, “B” harfini gören her kimyacı bor elementini anlar. Matematik için sayılar ne işe yarıyorsa, kimya içinde elementlerin bu kısa harflerinin gösterimi de o işe yarıyor.
Bilim Olarak Kimya: Elementler ve Bileşikler
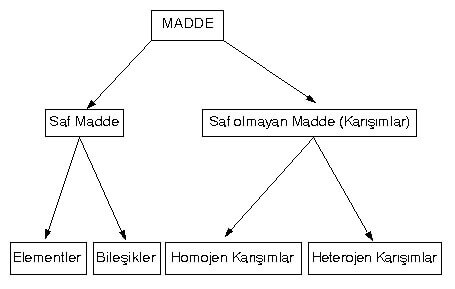
Uzayda yer kaplayan, hacmi olan, kütlesi olan, eylemsizlik gösteren, tanecikli yapıda olan herhangi bir şeye madde denir. Maddeler, saf madde ve karışım olmak üzere ikiye ayrılır. Karışımlar ise homojen ve heterojen karışımlar olmak üzere iki sınıfta incelenir; saf meddeler de element ve bileşik olmak üzere iki sınıfta incelenir.
Maddenin en küçük yapı birimi atomlardır. Atomlar birleşerek maddeleri meydana getirir.
I) Saf Madde
Tek cins atom içeren maddelerdir. Örneğin, su, alkol veya tuz, saf maddeler arasında gösterilmektedir. Saf maddeler belirli özelliklere sahiptirler, bu özellikler arasında yoğunluk, hal değişim sıcaklıkları (hal değiştirirken sıcaklık sabit kalır), çözünürlük ve esneklik katsayısı bulunur.
A) Elementler
Elementlerin yapısında aynı cins atomlar bulunur. Örneğin, O2 elementi oksijeni simgeler. Elementler saf ve homojenlerdir. Fiziksel veya kimyasal yöntemlerle daha basit bileşenlere parçalanamazlar.
- Monoatomik elementler: Doğada tek atomlu halde bulunan elementlerdir. Soygazlar bu gruba girer. He, Ne, Ar, Kr bu tip elementlere birer örnektir.
- Diatomik elementler: Doğada ikili moleküller halinde bulunan elementlerdir. Cl₂, H₂, O₂, N₂ bu tip elementlere örneklerdir.
- Poliatomik elementler: Doğada ikiden fazla atom içeren moleküller halinde bulunan elementlerdir. S₈ ve O₃ bu tip elementlere örnektir.
Elementler sembollerle gösterilir, sembolle göstermeyi ilk uygulayan kişi J.J. Berzelius’tur. Elementlerin monoatomik gösterimleri semboldür, moleküler gösterimleri formüldür. Örneğin, Fe, Cu, Cl, Ne, Ag, K, P gibi gösterimler monoatomik gösterimdir ve semboldür. N2, Cl2, O2 gibi gösterimler ise formüldür.
Elementler, metaller, ametaller ve soygazlar olmak üzere üç sınıfa ayrılır.
- Metaller: Parlaktır, elektriği iletebilirler, metallere şekil verilebilir ve oda sıcaklığında genellikle (civa sıvı) katı halde bulunurlar.
- Ametaller: Mattır, elektriği iletmez ve kırılgandırlar; oda sıcaklığında katı, sıvı veya gaz halde bulunabilirler.
- Soygazlar: Oda sıcaklığında hepsi gaz halinde bulunur, kararlıdırlar, bileşik yapmazlar. Helyum, Neon, Argon, Kripton, Ksenon ve Radon olmak üzere altı tanedirler.
B) Bileşikler
Bileşik, iki ya da daha fazla cins atomun bir araya gelerek oluşturduğu saf maddelere denir. Bileşikler, elementlerden farklı olarak farklı cins atomları içerirler. Örneğin, su bir bileşiktir ve 2 hidrojen atomuyla 1 oksijen atomunun birleşmesiyle oluşmuştur.
Bileşikler, tek tür tanecikten oluşur ve yapısındaki elementlerin özelliklerinden farklı özellikler gösterebilirler. Ayrıca, en az 2 farklı tür atom içerirler.
1) Bileşiklerin Sınıflandırılması
Bileşikler, iyonik bileşikler ve kovalent bileşikler olmak üzere iki sınıfa ayrılır.
- İyonik Bileşikler: Metal ve ametaller arasında elektron alışverişi gerçekleşmesiyle oluşan bileşiklerdir. Yapılarında iyonik bağ bulunur. Örnekler: NaCl, CaO, KCl, MgO, NaF.
- Kovalent Bileşikler: Elektronların atomlar arasında ortaklaşa kullanılmasıyla oluşan bileşiklerdir. Kovalent bileşikler, apolar kovalent bileşik ve polar kovalent bileşik olmak üzere ikiye ayrılır. Bu ayrımı ilerleyen konu anlatımlarında bulabilirsiniz. Yapılarında kovalent bağ bulunur. Örnekler: O2, F2, HF, HCl.
2) Bileşiklerin Kimyasal Formüllerle İfade Edilişi
Bileşikler, belirli sayıda element atomunun kimyasal bir bağ ile birleşmesiyle oluşur ve kimyasal formüllerle bu oran gösterilir. Bu formüllerin yazımında belirli kurallar bulunmaktadır. Örneğin, “NH3” amonyağın kimyasal formülüdür, ve bu formülde kullanılan alt indis (örneğimizdeki 3 sayısının bulunduğu yer) bağlanan atomların birbirine oranını gösterir. Bileşiklerin yazımında şu üç kurala dikkat edilir:
- Bileşiği oluşturan her atom, kendi element sembolü ile gösterilir.
- Her atomun sayısı, elementin sağ altında bulunan indis bölgesine yazılır.
- Atom sayısı 1 olan elementlerin alt indisine bir şey yazılmaz.
Bazı ikili bileşiklerin basit adlandırmaları
Kimyasal bileşiklerin birden fazla adı olabilir, bu adlandırmalar arasında sistematik, geleneksel ve ticari adlar bulunabilir. Halk arasında yaygın olarak bilinen bileşiklerde genellikle geleneksel isimler kullanılır. Örneğin, NH3, H2O ve CH3COOH gibi bileşiklerin sistematik isimleri yerine geleneksel olarak amonyak, su ve asetik asit terimleri kullanılır. Ticari bileşikler için de durum benzerdir.
Günümüzde bilinen bütün bileşiklerin ticari veya geleneksel adları bulunmamaktadır. Bu durumu çözmek için Uluslararası Kimya Birliği (IUPAC), bütün bileşikleri isimlendiren bir adlandırma sistemi geliştirmiştir. İki element içeren bazı bileşiklerin sistematik isimlendirmesi için şu kurallar geçerlidir:
Kural: (Sadece 2 elementten oluşan ikili bileşikler) İlk elementin adı sonra ikinci elementin adı yan yana getirilir. Genellikle ikinci element adının sonuna “-ür” eki eklenir. Eğer ikinci element oksijen ise “oksijenür” yerine “oksit” kelimesi eklenir.
Örnekler: NaCl = Sodyum klorür, HCl = Hidrojen Klorür, CaO = Kalsiyum oksit, KF = Potasyum Florür…
-
-
- CO = Karbon monoksit
- CO2 = Karbon dioksit
- NO = Azot monoksit
- N2O = Diazot monoksti
- NO2 = Azot dioksit
-
II) Karışımlar
Birden çok maddenin kimyasal olarak etkileşmeden bir arada bulunmasıyla (kimyasal özelliklerini kaybetmeden) oluşan maddelere karışım denir. Karışımlar dış görünüşleri baz alınarak homojen veya heterojen karışımlar olmak üzere ikiye ayrılır.
A) Homojen Karışımlar
Her tarafında aynı özellik gösteren, gözle veya optik bir araçla bakıldığında tek bir maddeymiş gibi gözüken karışımlardır. Tuzlu su, şekerli su gibi çözeltiler ve hava homojen karışımların en büyük örneklerindendir.
B) Heterojen Karışımlar
Heterojen karışımlar, tek bir maddeymiş gibi gözükmez, her yerinde aynı özelliği göstermez. Heterojen karışımları oluşturan saf maddeler, fiziksel yollarla birbirinden ayrılabilirler. Süt (yağ damlacıklarından dolayı), sis, odun parçaları, beton ve toprak heterojen karışımlara örnektir. Heterojen karışımların erime ve kaynama noktaları derişime bağlıdır; bu yüzden hal değiştirme sırasında maddenin sıcaklığı sabit kalmaz. Heterojen karışımlar, emülsiyon, süspansiyon, koloit, aerosol olmak üzere dörde ayrılır.
- Süspansiyon (katı – sıvı): Bir katının sıvı içerisinde çözünmeyip, parçacıklar halinde kalmasıyla oluşan karışımlardır. Su – kum karışımı, su – tebeşir tozu karışımı gibi.
- Emülsiyon (sıvı – sıvı): Bir sıvıda çözünmeyen başka bir sıvının heterojen olarak bulanık bir şekilde dağılmış hâlidir. Su–zeytinyağı karışımı, su–benzin karışımı, gibi.
- Koloit: Bir maddenin sıvı içerisinde asılı kalmasıyla oluşan karışımlara denir. Jöle, duman ve boya gibi maddeler bu karışım türüne örnektir.
- Aerosol (katı veya sıvı – gaz): Bir katı veya sıvının gaz içinde dağılmasıyla oluşan karışımlardır. Sis, sprey, baca dumanı buna örnektir. Aerosol karışımların çoğu koloite örnektir.