Çözücü ve Çözünen Etkileşimleri
Çözelti Oluşumu ve Düşünce Birimleri
Çözelti, iki veya daha fazla madde tarafından oluşturulan homojen bir karışıma denir. Örnek olarak, hava bir çözeltidir, içinde azot, oksijen, karbondioksit gibi gazlar bulunur. Bir çözeltiyi oluşturan bileşenlerden miktarı daha fazla olan madde, aynı zamanda çözünme sürecinde aktif bir rol oynayan madde olarak “çözücü” olarak adlandırılır. Diğer bileşenlere ise “çözünen” denir.
Çözücü – Çözünen Etkileşimleri
Çözücü ve çözünen taneciklerin birbirleriyle karışması sırasında, çözücü tanecikleri çözünen taneciklerini çevreler. Bu süreç çözünme olarak adlandırılır. Bir madde başka bir maddeyi çözebilmek için, her iki madde arasındaki moleküler çekim kuvvetlerinin uygun olması gerekmektedir. Genellikle benzer türdeki maddeler birbirlerinde çözünür. Yani, polar çözücüler genellikle polar yapıdaki maddeleri çözerken, apolar çözücüler apolar yapıdaki maddeleri çözerler.
CH4, CO2, I2, CCl4 ve C2H6 gibi moleküller apolar yapılara sahiptir ve birbirleriyle çözünürler. Bu tür moleküller arasındaki etkileşim, London kuvvetleri tarafından sağlanır. Öte yandan, H2O, CH3Cl, HF, H2S gibi sıvılar polar yapıya sahiptir. Bu tür maddeler, dipol-dipol etkileşimleri oluşturarak birbirlerinde çözünürler. Ayrıca, bazı moleküllerde hidrojen bağları nedeniyle moleküller arasında güçlü çekim kuvvetleri gözlemlenebilir.
Örneğin, su polar bir bileşiktir ve benzer şekilde polar bir molekül olan metanol ile her oranda kolayca karışabilir. Su ve metanol karışımı sırasında moleküller arasında hidrojen bağları oluşur ve bu nedenle karışım homojen bir görünüm sunar.
Polar moleküllerin “+” ve “-” uçları vardır. Farklı moleküllerin zıt yüklü uçları arasındaki etkileşimler, moleküller arasındaki uzaklığa bağlı olarak iki farklı şekilde gerçekleşir.
Çözünme Örnekleri
Bazı çözünme örnekleri şunlardır:
- Apolar bir molekül olan CCl4, polar bir molekül olan su içinde çözünmez. Bu, H2O molekülleri arasındaki dipol-dipol etkileşimlerinin, CCl4 ile H2O arasında oluşabilecek dipol-indüklenmiş dipol bağlarından daha güçlü olmasından kaynaklanır.
- Apolar bir molekül olan I2 katı, apolar bir molekül olan CCl4 içinde iyi çözünür. Bunun nedeni I2 ile CCl4 arasındaki London kuvvetlerinin, I2 molekülleri arasındaki kuvvetlerden daha güçlü olmasıdır.
- Sağlam bir ağ örgüsüne sahip kristaller, hiçbir çözücüde çözünmezler. Bu tür kristallerin çözünmemesi, yapısını bozacak bir çözücü-çözünen etkileşiminin olmamasından kaynaklanır.
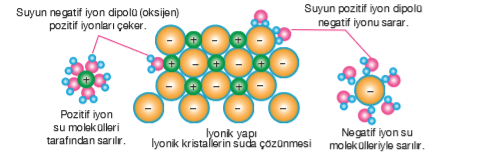
- Çoğu iyonik ve polar kovalent bileşikler için su, ideal bir çözücüdür. Çözünme sırasında iyonik maddelerin pozitif ve negatif iyonları, polar kovalent maddelerin ise dipolleri, polar su molekülleri tarafından elektrostatik olarak çekilir.
- Örnek olarak KCl (potasyum klorür) düşünülebilir. KCl iyoniktir ve H2O polar yapıya sahiptir. KCl iyonları, su molekülleri tarafından çevrelenir ve tutulur. Bu sırada, tuzun pozitif iyonu (K+) suyun negatif kısmı tarafından sarılırken, tuzun negatif iyonu (Cl-) suyun pozitif kısmı tarafından sarılır. Bu tür etkileşime iyon-dipol etkileşimi denir. Su molekülleri, K+ ve Cl- iyonlarını taşıyarak çözelti içinde dağıtır, böylece bir çözelti oluşur.
Hidratlaşma ve Solvatasyon
Çözünmüş iyonlar, su molekülleri ile çevrelendiğinde, bu sürece hidratlaşma (hidratasyon) adı verilir. Ancak, başka bir çözücü kullanıldığında, çözünmüş iyonlar bu çözücü ile çevrelenirse, bu sürece solvatasyon (solvatize olma) denir.
Derişim Birimleri
Çözeltide bulunan çözünmüş madde miktarına “derişim” veya “konsantrasyon” denir. En yaygın olarak kullanılan derişim birimleri molarite ve molalitedir.
Molarite (M)
1 litre çözeltide bulunan çözünen maddenin mol sayısına molarite veya molar derişim denir ve “M” ile gösterilir. Molaritenin birimi mol/litredir.
Molarite (M) = Çözünen madde miktarı (mol) / Çözeltinin hacmi (litre) ⇒ M = n/V
Molalite (m)
1 kilogram çözücü içinde çözünen maddenin mol sayısına molalite denir ve “m” ile gösterilir. Molalite terimi yerine sıklıkla “molal” kelimesi kullanılır. Molalitenin birimi mol/kilogramdır.
Molalite (m) = Çözünen madde miktarı (mol) / Çözücünün ağırlığı kilogram cinsinden (kg) ⇒ m = n/kg