
Homojen ve Heterojen Karışımlar
Heterojen Karışımlar
Heterojen karışımlar, özellikleri her yerde aynı olmayan karışımlardır. Bu tür karışımlarda, karışımı oluşturan tanecikler birbiri içerisinde homojen bir şekilde dağılmazlar. Kum-su, zeytinyağı-su gibi karışımlar çıplak gözle bile incelendiğinde heterojen karışımlar olduğu anlaşılır.
Bazı karışımları ayırt etmek için büyüteç, ışık veya mikroskop kullanmak gerekebilir. Örneğin, süt bu karışıma en iyi örnektir. Süt mikroskopla incelendiğinde, su ve yağ dağılımının her yerinde aynı olmadığı görülür.
Heterojen karışımların sınıflandırılması, genellikle birden çok fazdan oluşur. Bu fazlar, dağıtan faz ve dağılan faz olarak adlandırılır ve karışımı oluşturan maddelerin fiziksel haline göre aşağıdaki gibi sınıflandırılır:
- Süspansiyon: Katı parçacıkların bir sıvı içinde dağıldığı heterojen karışımlardır.
- Emülsiyon: Sıvı parçacıkların bir sıvı içinde dağıldığı heterojen karışımlardır.
- Aerosol: Sıvı veya katı parçacıkların gaz içinde dağıldığı heterojen karışımlardır.
- Adi Karışım: Gözle görülebilen farklı fazlardan oluşan basit heterojen karışımlardır.
Heterojen karışımlar, birçok doğal ve endüstriyel süreçte önemli bir rol oynarlar ve farklı fazların dağılımı, karışımın özelliklerini belirleyen önemli bir faktördür.
Emülsiyon:
Sıvı dağıtan ve dağılan fazları içeren karışımlara emülsiyon denir. Su-zeytinyağı karışımı, su-mazot karışımı, süt, mayonez gibi örnekler verilebilir. Emülsiyonlar kararlı değildir, yani bir süre bekletildiklerinde iki veya daha fazla farklı sıvı faza ayrılırlar.
Süspansiyon:
Sıvı dağıtan ve katı dağılan fazları içeren karışımlara süspansiyon denir. Tebeşir tozu-su, çamurlu su, kum-su karışımı gibi örnekler verilebilir. Süspansiyonlarda, katı faz zamanla yer çekiminin etkisiyle çöker.
Aerosol:
Gaz dağıtan ve katı veya sıvı dağılan fazları içeren heterojen karışımlara aerosol denir. Sis, sprey ve bulut sıvı aerosoldür. Duman, tozlu hava katı aerosoldür.
Adi Karışım:
Katı-katı heterojen karışımlardır. Adi (basit) karışımlarda, dağılan ve dağıtan faz ayrımı yapılamaz. Kum-şeker, tuz-şeker, pirinç-bulgur, kuruyemiş karışımları adi karışımlara örnek verilebilir.
Kolloid:
Bir maddenin başka bir madde içerisinde gözle görülemeyecek kadar küçük tanecikler halinde dağılmasıyla oluşan heterojen karışımlardır. Süspansiyonlar, emülsiyonlar ve birçok aerosol çeşidi kolloiddir. Kolloid karışımlar genellikle homojen görünümlüdür ve üzerine ışık demeti uygulandığında ışığı her yöne farklı şekilde dağıtır. Homojenize süt, duman, mürekkep, kan, boya, sis ve jel kolloid örnekleridir.
Bu heterojen karışımlar, doğal ve endüstriyel süreçlerde çeşitli amaçlar için kullanılır ve kimyanın önemli bir alanını oluştururlar.
Heterojen Karışımların Tanecik Boyutuna Göre Sınıflandırılması
Heterojen karışımlar, içerdikleri dağılan taneciklerin boyutuna göre sınıflandırılır.
- Homojen (Çözelti):
Dağılan taneciklerin boyutu 10^-9 metreden (1 nm) küçük olduğunda homojen karışım, yani çözelti oluşur. Bu tür karışımlar, gözle görülemeyecek kadar küçük tanecikler içerir ve çıplak gözle ayırt edilemezler. - Kolloidal Karışım:
Dağılan taneciklerin boyutu 10^-9 metreden (1 nm) 10^-6 metreye (1000 nm) kadar olan aralıkta ise kolloidal karışım oluşur. Bu tür karışımlar kolloid olarak adlandırılır ve tanecikleri mikroskopla görülebilir fakat çıplak gözle ayırt edilemez. - Süspansiyon:
Dağılan taneciklerin boyutu 10^-6 metreden (1 μm) büyükse süspansiyon oluşur. Bu tür karışımlarda tanecikler gözle görülebilir ve zamanla dibe çökerler. Bu nedenle bu tür süspansiyonlar kaba süspansiyon olarak adlandırılır.
Aerosolde, dağılan maddenin boyutu 1 nm ile 1000 nm aralığında ise kolloidal adını alır. Bu tür karışımlar, hava içinde asılı halde olan katı veya sıvı taneciklerden oluşur ve bu tanecikler mikroskopla görülebilir boyutta olduğundan kolloidal adını alır.
Heterojen karışımların tanecik boyutları, karışımların özelliklerini ve davranışlarını belirleyen önemli bir faktördür. Bu sınıflandırma, karışımların çeşitli uygulamalarda ve endüstriyel süreçlerde kullanılmasında önemli bir rol oynar.
Kolloid ve Çözeltilerin Tyndall Olayı ile Ayırt Edilmesi
Çözeltilerde, tanecikler atomik büyüklükte olduğundan süspansiyon içerisinde dağılan parçacıklar atomların çapından çok daha büyüktür. Kolloid tanecikleri ise 1 nm ile 1000 nm arasındaki çaplara sahiptir. Kolloidler, ışığı saçma (daptırma) özelliğine sahiptir. Kolloidal karışımların ışığı saçma özelliğine “Tyndall etkisi” denir. Tyndall etkisi, kolloidleri çözeltilerden ayırt etmek için kullanılan bir yöntemdir.
Örneğin, tozlu hava bir kolloid karışımıdır. Güneş ışınları, tozlu havanın içinden geçerken dağılır ve bu sayede toz zerrecikleri görülebilir hale gelir. Parlak ışığın toz tanecikleri tarafından saçılması, Tyndall etkisine güzel bir örnektir. Bu etki, kolloidlerin ışığı saçma özelliği nedeniyle ortaya çıkar ve çözeltilerden ayırt edilmesine yardımcı olur.
Tyndall etkisi, gözle görülen parçacıkların ışığı saçması ve bu sayede karışımın homojen olmayan yapısının fark edilmesini sağlar. Bu özelliği sayesinde, kolloid ve çözeltiler arasındaki farkı belirlemek için kullanılan önemli bir gözlem yöntemidir.
Homojen Karışımlar ve Özellikleri
Homojen Karışımlar ve Özellikleri:
Karışımı oluşturan maddelerin her noktada eşit oranda dağıldığı karışıma homojen karışım denir. Homojen karışımlara çözelti de denir. Dışarıdan bakıldığında homojen karışımlar, tek bir madde gibi görünürler.
Karışımı oluşturan maddeler, her oranda karışabilir veya sıcaklık ve basınca bağlı olarak belirli oranlarda karışabilirler.
Çözeltiler, çözücü ve çözünen adı verilen bileşenlerden oluşur. Örneğin, tuz-su karışımında tuz çözünen, su çözücü ve tuzlu su çözeltidir. Çözeltideki bileşenlerden genellikle miktarı fazla olana çözücü, miktarı az olana çözünen denir. Ancak bu tanımlama her zaman çözeltiler için geçerli olmayabilir. Bazen çözücü miktarı az olabilir, bazı koşullarda ise çözücü ve çözünen arasındaki kütlesel fark çok az olabilir. Gaz çözeltileri bu tür çözeltilere örnek verilebilir. Gaz tanecikleri arasında etkileşim kuvvetleri yok denecek kadar azdır. Bu nedenle gaz tanecikleri her zaman birbirleriyle homojen olarak ve her oranda karışabilir.
İki ya da daha çok metalin, bir metal ile yarı metalin veya bazen bir metal ile ametalin eritilip karıştırılmasıyla oluşan karışımlara alaşım denir. Alaşımlar genellikle katılar arasında oluşan homojen veya heterojen karışımlardır.
Çözeltiler, çözücü ve çözünenin fiziksel hallerine göre sınıflandırılır. Homojen karışımlarda çözücü ve çözünen katı, sıvı ve gaz halinde olabilir.
Çözeltiler, katı, sıvı ve gaz çözeltileri olmak üzere üçe ayrılır. Çözeltinin fiziksel halini çözücü belirler. Çözücü katı ise katı çözelti, sıvı ise sıvı çözelti, gaz ise gaz çözelti adını alır.
Çözeltilerde çözücü ve çözünenin kütlesinin toplamı çözelti kütlesine eşittir. Ancak çözücü ve çözünenin hacimleri toplamı çözelti hacmine eşit değildir.
Moleküllerin homojen karışımları olan çözeltiler, birçok alanda önemli bir rol oynar ve kimyanın temel konularından biridir.
Moleküler Düzeyde Çözünme Süreci
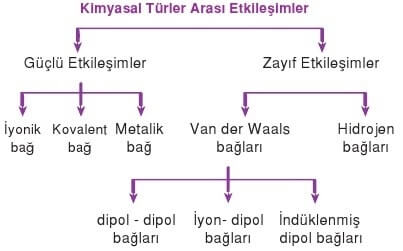
Maddelerin çözünmesi iyonik veya moleküler olarak meydana gelir. Maddelerin iyonik veya moleküler olarak çözünme sürecini, aralarında oluşturdukları etkileşimler belirler.
Çözücü olarak su kullanıldığında, çözünen maddenin tanecikleri H2O molekülleri tarafından sarılarak hidrasyon oluşturur. Eğer çözücü su dışındaki bir madde ise, bu durumda solvasyon meydana gelir. Hem hidrasyon hem de solvasyon, sıvı sarılım olarak adlandırılır.
Çözünen maddelerin birbiri içinde çözünmesi, türler arası zayıf etkileşim kuvvetlerine bağlıdır. Tanecikler arası etkileşimler madde türüne göre değişir. Maddelerin birbiri içinde çözünmesi, zayıf etkileşimlerin oluşmasına bağlıdır. Çözünme sürecinde, çözücü ve çözünen arasında hidrojen bağları, dipol-dipol, iyon-dipol, dipol-indüklenmiş dipol ve indüklenmiş dipol-indüklenmiş dipol etkileşimleri oluşabilir.
Polar çözücüler ve iyonik bileşikler arasında iyon-dipol etkileşimi oluşur. Örneğin, sofra tuzunun (NaCl) suda çözünmesi, iyon-dipol etkileşimlerinin sonucudur. Su molekülleri, Na+ ve Cl- iyonlarıyla etkileşime girerek tuzun çözünmesini sağlar.
Polar çözücülerin polar çözünenleri çözmesi dipol-dipol etkileşimi ile gerçekleşir. Örneğin, hidrojen klorür (HCl) bileşiğinin suda çözünmesi sırasında, çözücü su molekülleri ve çözünen HCl molekülleri arasında dipol-dipol etkileşimleri oluşur.
Apolar çözücülerin apolar maddeleri çözmesi sırasında, çözücü ve çözünen tanecikleri arasında London kuvvetleri oluşur. Örneğin, O2-CCl4 ve CO2-C6H6 gibi apolar moleküller birbiri içinde çözündüğünde aralarında London kuvvetleri etkileşimi oluşur.
Şeker, suda moleküler olarak çözünür. Şekerin suda çözünmesi sırasında şeker molekülleri ve su molekülleri arasında hidrojen bağı oluşur. Su molekülleri, şeker moleküllerinin arasına girerek şekerin suda dağılmasını sağlar.
Apolar molekül ile polar moleküller arasında dipol-indüklenmiş dipol etkileşimi oluşur. Örneğin, I2, suda dipol-indüklenmiş dipol etkileşimi oluşturarak az miktarda çözünür. Fakat dipol-indüklenmiş dipol etkileşimi oldukça zayıf olduğundan apolar moleküllerin polar moleküllerdeki çözünmesi genellikle ihmal edilir.
İyonik bileşikler ile apolar moleküller arasında iyon-indüklenmiş dipol etkileşimi oluşur. Örneğin, KCl iyonik bileşiğinin apolar molekül olan CCl4’de çözünmesi sırasında, iyon-indüklenmiş dipol etkileşimi oluşur. Ancak iyon-indüklenmiş dipol etkileşimi oldukça zayıf olduğundan, iyonik bileşiğin apolar moleküllerdeki çözünmesi genellikle ihmal edilir.
b) Çözücü – Çözünen Benzerliği
Benzer benzeri çözer ilkesiyle, çoğunlukla polar maddeler polar çözücülerde, apolar çözücüler ise apolar çözücülerde iyi çözünür. Yani, polar maddeler polar çözücülerle daha iyi çözünme eğilimindedir, ve aynı şekilde apolar maddeler de apolar çözücülerle daha iyi çözünme eğilimindedir. Apolar maddelerin polar çözücülerde çözünmesini beklememeliyiz.
 Apolar maddeler arasında sadece indüklenmiş dipol-indüklenmiş dipol zayıf etkileşimleri oluşur. Polar moleküller arasında ise hidrojen bağı, dipol-dipol etkileşimi ve London kuvvetleri oluşur. Bu etkileşimler arasında en güçlü olan hidrojen bağıdır, ve çözünme olayında hidrojen bağı etkilidir.
Apolar maddeler arasında sadece indüklenmiş dipol-indüklenmiş dipol zayıf etkileşimleri oluşur. Polar moleküller arasında ise hidrojen bağı, dipol-dipol etkileşimi ve London kuvvetleri oluşur. Bu etkileşimler arasında en güçlü olan hidrojen bağıdır, ve çözünme olayında hidrojen bağı etkilidir.
H2O, HF, NH3, C2H5OH, CH3COOH, C6H12O6, C2H5NH2 gibi benzer polar yapılı moleküller, kendi aralarında ve birbirleri ile hidrojen bağı, dipol-dipol etkileşimleri ve London kuvvetleri oluşturur. Ancak bu etkileşimler arasından en güçlü olan hidrojen bağı olduğu için çözünme olayında hidrojen bağı etkilidir.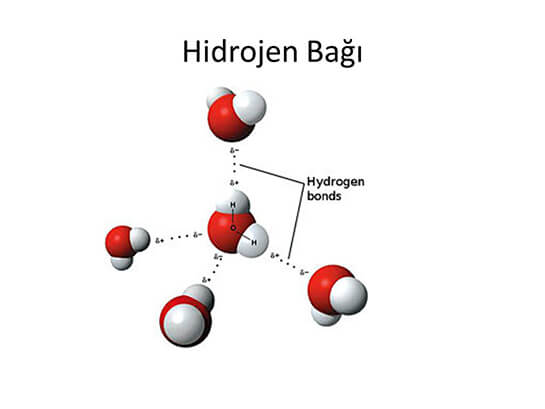
HCl, HI, H2S, HBr, NF3, NCl3, CHCl3 gibi benzer polar yapılı bileşiklerin molekül yapıları polardır. Bu moleküller birbirleriyle ve polar su molekülleriyle dipol-dipol etkileşiminde çözünür.
H2, Cl2, I2, CH4, CCl4, C6H6 gibi apolar yapılı maddelerin kendi molekülleri arasında sadece London kuvvetleri vardır, ve bu moleküller birbirleri içinde çözünürken moleküller arasında da London kuvvetleri oluşur. Örneğin, I2 katı maddesi CCl4 sıvısında iyi çözünmesinin nedeni iki molekülün de apolar olmasındandır.
NOT I:
Karışımların tanecikleri arasındaki etkileşimler karışımın kaynama noktası, donma noktası, buhar basıncı, uçuculuk gibi birçok özelliklerini etkiler.
NOT II:
Elektrik akımını elektrolit adı verilen çözeltiler iletebilir. Elektrolit çözeltiler suda kısmen veya tamamen iyonlaşarak çözünen maddelerin çözeltileridir. Tuzlu su en yaygın örnektir. Elektrik akımını suda moleküler çözünen maddeler iletemez ve bu tür çözeltilere elektrolit olmayan çözeltiler denir. Şeker suda moleküler çözündüğü için şekerli su elektriği iletmez.
NOT III:
Çözeltiyi oluşturan molekülün kütlesi ve toplam elektron sayısı arttıkça, moleküller arasındaki London kuvvetleri artar ve bu durum moleküllerin erime ve kaynama noktalarını yükseltir.
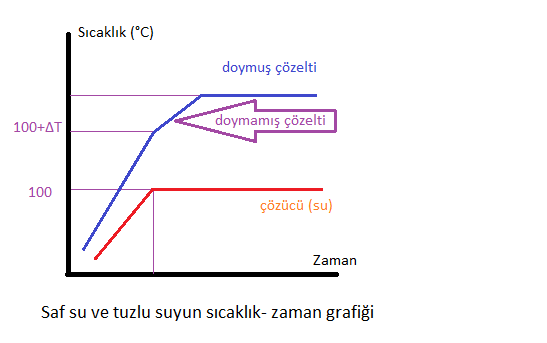 Çözeltiler ısıtılmaya devam edildiğinde, çözücü miktarı azalır ve çözelti derişimi artar. Bu durum kaynama noktasını daha da yükseltir ve çözelti sıcaklığı artmaya devam eder. Ancak bir süre sonra çözelti doyma noktasına ulaşır ve birim hacimde çözünen miktarı artmaz. Dolayısıyla, çözelti doyma noktasına ulaştığında sabit sıcaklıkta kaynamaya devam eder.
Çözeltiler ısıtılmaya devam edildiğinde, çözücü miktarı azalır ve çözelti derişimi artar. Bu durum kaynama noktasını daha da yükseltir ve çözelti sıcaklığı artmaya devam eder. Ancak bir süre sonra çözelti doyma noktasına ulaşır ve birim hacimde çözünen miktarı artmaz. Dolayısıyla, çözelti doyma noktasına ulaştığında sabit sıcaklıkta kaynamaya devam eder.