
Periyodik Özellikler
Periyodik Özellikler – Detaylı
.
Periyodik tablonun bilim insanlarına sağladığı en büyük avantaj, bir elementin konumunu bilerek hızla çeşitli bilgilere ulaşabilme imkanıdır. Periyodik tablonun yapısı gereği, bir dizi özellik periyodik bir şekilde artar veya azalır. Bu özelliklere “periyodik özellikler” denir. Periyodik özelliklerin çoğu, elektronların orbitallere düzenlenişine bağlı olarak açıklanabilir (veya daha basit bir ifadeyle, atomun yarıçapının büyüklüğüne bağlıdır).
I) Elektronegatiflik
Elektronegatiflik, bir molekül içindeki bir atomun elektronları çekme yeteneğinin bir ölçüsüdür. Genel olarak elektronegatiflik, periyodik cetvelde soldan sağa doğru ilerlerken değerlik elektron sayısının artmasıyla artar. Gruplarda ise yukarıdan aşağıya doğru inildikçe atom büyüklüğünün artmasıyla azalır. En yüksek elektronegatifliğe sahip atom flor atomudur. Elektronegatiflik kavramını ilk defa tanımlayan kişi Amerikalı kuantum kimyager Linus Pauling’dir. Pauling’in önerdiği elektronegatiflik değerleri 0.7 ile 4 arasında değişir.
Elektronegatifliği tanımlayan bir diğer kişi ise Robert Mulliken’dir ve bu tanım atom özelliklerine dayanır. Mulliken’e göre, “Bir atom yüksek iyonlaşma enerjisi ve yüksek elektron ilgisi gösteriyorsa, bu atom elektron kazanma eğilimindedir ve yüksek elektronegatifliğe sahiptir.”
Elektronegatiflik değerini hesaplamak için Mulliken tarafından önerilen eşitlik şu şekildedir:
EN = 1/2(K)(IE + EI)
Burada,
EN: Elektronegatiflik
K: Sabit bir değer
IE: İyonlaşma enerjisi
EI: Elektron ilgisi
Eşitlikteki K sabit değeri, özel bir seçimle belirlenir. Flor elementi en yüksek elektronegatifliğe sahip olarak kabul edilir ve bu nedenle K sabit değeri genellikle 4.0 olarak alınır.
II) Atom Yarıçapı
Bir periyotta soldan sağa doğru, çekirdek yükü artar ve çekirdeğin elektronları çekme gücü artar. Bu nedenle atom çapı küçülür. Aynı grupta yukarıdan aşağıya doğru atom numarası arttıkça enerji düzeyi (yörünge) sayısı da artar, bu da çekirdeğin elektronları çekme gücünün azalmasına neden olur, dolayısıyla atom çapı artar.
Yüksüz bir atom negatif yüklü bir iyon haline geldiğinde elektron alır. Elektron sayısı proton sayısından fazla olduğu için çekirdeğin çekim gücü azalır ve hacmi büyür. Yüksüz bir atom pozitif yüklü bir iyon haline geldiğinde ise elektron verir. Proton sayısı elektron sayısından fazla olduğu için çekirdeğin çekim gücü artar ve çapı küçülür.
A) Kovalent Yarıçap
Ametal atomları kovalent bağlarla birbirlerine bağlanarak moleküller oluştururlar (örneğin, Cl-Cl gibi ametal molekülleri arasında). Kovalent yarı çap, iki eşdeğer atomun tek bir kovalent bağla birbirlerine bağlandığında çekirdekleri arasındaki uzaklığın yarısıdır. Örneğin, bir H2 molekülünde çekirdekler arasındaki uzaklık 174 pm olduğunda, klorun kovalent yarı çapı 87 pm olur. (Bu uzaklıklar, örnekleri daha iyi anlamak için verilmiştir.)
B) Van der Waals Yarıçapı
Katı haldeki soy gazların, apolar moleküller arasındaki hesaplanan yarı çapına Van der Waals yarıçapı denir. Van der Waals kuvvetleri, katı haldeki soy gazları bir arada tutan kuvvetlerdir. Van der Waals yarı çapı, ölçülen mesafenin yarısı kadardır.
C) İyonik Yarıçap
Metal atomu ile ametal atomlar arasındaki iyonik bileşiklerdeki katyonun veya anyonun yarıçapına “iyonik yarıçap” denir.
III) Metallik – Ametallik
Periyodik tabloda bulunan elementlerin büyük bir kısmı metaldir. Bir periyotta soldan sağa doğru elementlerin elektron verme eğilimi azalırken, elektron alma eğilimi artar. Bu nedenle ametaller, periyodik tablonun sağ tarafında yer alırken, metaller sol tarafta toplanmıştır.
Aynı grup içinde ise yukarıdan aşağıya doğru metalik özellik artarken ametallik özellik azalır. Bu, atom çapının yukarıdan aşağıya doğru artması ve en dış elektronları çeken çekirdek kuvvetinin zayıflaması sonucunda gerçekleşir, bu durum metallerin metalik özelliklerini artırır.
IV) Elektron İlgisi
Gaz fazında bulunan nötr bir atomun bir elektron kazanarak negatif yüklü bir iyon oluşturması sırasında açığa çıkan enerjiye “elektron ilgisi” denir. Elektron ilgisi, atomun boyutu ile ilişkilidir. Atom ne kadar küçükse, elektrona çekirdek yükünün etkisi o kadar büyük olur. Bu nedenle elektron ilgisi, periyodik tabloda genellikle soldan sağa doğru artar ve yukarıdan aşağıya doğru azalır. Aynı grupta ise yukarıdan aşağıya doğru elektron ilgisi genellikle azalır. Bu nedenle, örneğin, Cl atomunun elektron ilgisi, F atomuna göre genellikle daha düşüktür.
V) İyonlaşma Enerjisi
Gaz halindeki nötr bir atomun en yüksek enerji düzeyinden bir elektron çıkarmak için gereken enerji miktarına iyonlaşma enerjisi denir. Gaz halindeki nötr bir atomdan bir elektron çıkarmak için gerekli enerjiye ise birinci iyonlaşma enerjisi denir.
X(g) + E1 → X+(g) + e-
E1: Birinci iyonlaşma enerjisi (kJ/mol)
Aynı atomdan üçüncü, dördüncü elektronlar da koparılabilir ve her elektron koparma işlemi için bir iyonlaşma enerjisi hesaplanabilir. Atomun sahip olduğu elektron sayısı kadar iyonlaşma enerjisi bulunabilir. Atom çapı küçüldükçe elektron koparmak daha zorlaşır ve bu nedenle iyonlaşma enerjisi artar. Dolayısıyla, bir atomun iyonlaşma enerjileri arasındaki ilişki her zaman şu şekildedir: … > E4 > E3 > E2 > E1.
Periyodik tabloda soldan sağa doğru çekirdek yükü artar. Bu, değerlik elektronlarının çekirdek tarafından daha güçlü bir şekilde çekilmesine yol açar. Bu nedenle elektronu çıkarmak daha zor hale gelir ve iyonlaşma enerjisi artar.
Aynı grupta ise yukarıdan aşağıya doğru atom çapı artar. Çekirdeğin elektronları çekme gücü azalır. Bu nedenle elektronu çıkarmak için daha az enerji gerekir ve bu da iyonlaşma enerjisinin azalmasına neden olur.
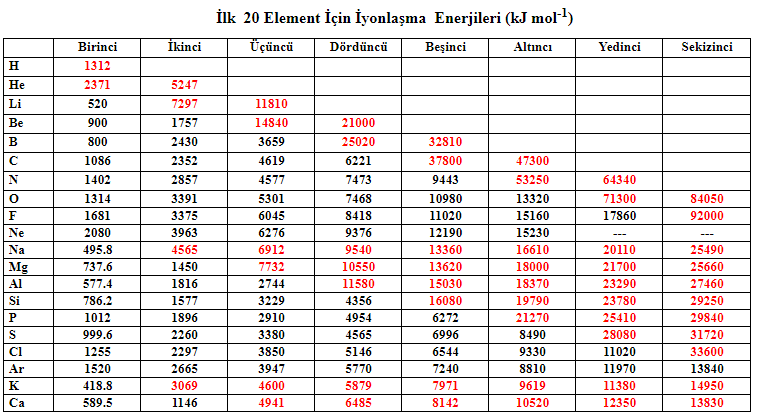
Son olarak grup bakımından incelendiğinde iyonlaşma enerjilerini şu şekilde sıralayabiliriz.
1A<3A<2A<4A<6A<5A<7A<8A
