Modern Atom Teorisi
Modern Atom Teorisi: Atom Kavramının Tarihsel Gelişimi
Atomlar hakkındaki fikirler, tarih boyunca çok eski olmalarına rağmen 20. yüzyıla kadar öznel yargılardan öteye gidemedi. Maddelerin atomlardan oluştuğu fikri eski olsa da, atomlarla ilgili bilgilerimiz oldukça yeni sayılır. Antik Yunan filozofları atomları bölünemez en küçük parçalar olarak düşünmüşlerdir, ancak bu konudaki teoriler zaman içinde geçerliliğini kaybetmiştir (Atom sözcüğü Yunanca “bölünemez” anlamına gelen “atomos” sözcüğünden türetilmiştir). Günümüzde, atomların çok küçük olduğunu, artı yüklü bir çekirdekten oluştuğunu ve çekirdeğin çevresinde elektronların bulunduğunu biliyoruz. Aynı zamanda atomların elektromanyetik ışıma yaptığını ve elektriksel olarak nötr olduklarını da söyleyebiliriz.
Atomlar, bir elementin bütün özelliklerini taşıyan en küçük parçacıklardır ve yalnızca taramalı tünel mikroskobu (atomik kuvvet mikroskobu) ile incelenebilirler.
Eski Yunan atom kuramları deneysel verilere dayanmıyordu ve yaklaşık 2000 yıl boyunca sadece tartışma konusu olarak kaldı. Ancak John Dalton’un 1803-1808 yılları arasında geliştirdiği ve önerdiği atom kuramı, kimya tarihinde önemli bir kilometre taşı olmuştur.
I) Atomla İlgili Düşünceler
A) Dalton Atom Modeli
Kimyanın temel yasalarından olan sabit ve katlı oranlar yasalarından yola çıkarak geliştirilen ilk atom modeli, John Dalton’un ortaya attığı bir modeldir. Bu model aşağıdaki şekilde özetlenebilir:
- Maddeler, atom adını verdiğimiz çok küçük ve bölünemeyen taneciklerden oluşur.
- Kimyasal tepkimelerde atomlar bir bütün olarak davranır. Atomlar parçalanamaz veya yeniden oluşturulamaz.
- Bir elementin tüm atomları, şekil, büyüklük ve kütle bakımından birbirleriyle aynıdır. Ancak farklı elementlerin atomları birbirinden farklıdır.
- Atomlar, birleşerek molekülleri oluşturur. Bir bileşikteki tüm moleküller aynıdır ve molekül içindeki atom sayıları arasında basit bir oran vardır.
Dalton atom modelinin eksiklikleri şunlardır:
- Maddelerin en küçük yapı taşı atom değil, daha küçük parçacıklar içerebilir.
- Atomların içi tamamen dolu değildir; büyük boşluklar içerirler ve farklı yapılarla sahip olabilirler.
- Atomlar nükleer reaksiyonlarla parçalanabilir.
- Aynı cins elementlerin atomları, büyüklük ve kütle bakımından farklı olabilir (izotoplar).
- Farklı cins elementlerin atomları da farklıdır.
- Bir bileşiği oluşturan atomların kütleleri arasında basit tam sayılarla ifade edilen bir oran vardır.
Bu açıklamalar, John Dalton’un atom modelinin eksikliklerini ve daha sonraki bilimsel gelişmelerin atom anlayışını nasıl değiştirdiğini özetlemektedir.
Dalton Atom Modeli İle Modern Atom Teorisi Karşılaştırması
| Dalton Atom Teorisi | Modern Atom Teorisi |
|---|---|
| Atom en küçük parçacıktır ve bütün elementler atomlardan meydana gelir. | Atomu oluşturan parçacıkların bulunması atomun en küçük yapı olmadığını göstermiştir. |
| Atom bölünemez, parçalanamaz ve yeniden oluşturulamaz. | Atomlar çekirdek tepkimeleri sonucu parçalanabilir veya başka bir atoma dönüşebilir (fisyon ve füzyon). |
| Bir elementin bütün atomlarının boyutları, kütleleri ve kimyasal özellikleri aynıdır. Farklı elementlerin atomları ise kendi içinde aynıdır, diğer elementlerden farklıdır. | Bir elementin kimyasal özellikleri aynı olsa dahi fiziksel özellikleri ve kütleleri farklı olabilir (izotop). |
| Bileşikler birden çok elementin atomlarından oluşur. | Bileşikler birden çok elementin atomlarından oluşur. |
| Atomlar içi dolu kürelerdir. | Atomlar boşluklu yapılardır. |
B) Thomson Atom Modeli
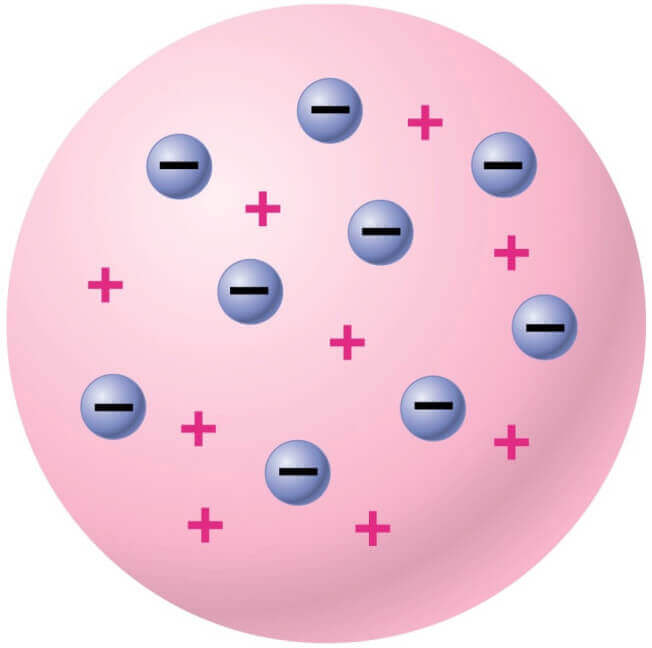
1900’lerin başında, yaklaşık 100 yıl sonra Dalton’un çalışmalarından, Joseph Thomson yeni bir atom modeli geliştirdi. Atom yapısıyla ilgili çalışmalar, elektrik yükünün yüklü taneciklerden oluştuğunu gösterdi ve Joseph John Thomson, katot ışınları ile yaptığı deneylerde negatif yüklü taneciklerin, yani elektronların varlığını tespit etti. Elektronların varlığının kanıtlanmasından sonra, Dalton Atom Modeli yeni bir şekil aldı. Atomlar yüksüz tanecikler olmalarına rağmen, atom içinde (-) yüklü elektronları nötrleştiren (+) yüklerin de bulunması gerektiğini belirtti ve bu artı (+) yüklü taneciklere proton adını verdi. J.J. Thomson’a göre:
- Bir atomda elektronların sayısı protonların sayısına eşittir, bu nedenle atomlar yüksüzdür.
- Elektronların kütlesi, atomdaki protonların kütlesinden çok daha küçüktür, bu yüzden atomların başlıca artı yüklerden oluştuğunu söyledi.
- Atom bir küre şeklindedir ve elektriksel dengeyi sağlamak için elektronlar ve protonlar küre içinde dağılmışlardır.
Thomson atom modelini üzümlü keke benzetebiliriz. Kekin hamur kısmı pozitif yükleri temsil ederken, üzümler rastgele dağılmış negatif yükleri simgeler.
Thomson Atom Modeli’nin eksiklikleri şunlardır:
- Elektronlar atom üzerinde rastgele dağılmış değildir.
- Atomlar, pozitif yüklü kürecikler olarak düşünülemez.
- Nötronlar hakkında herhangi bir bilgi sunmamıştır.
Thomson Atom Modeli ile Modern Atom Teorisi Karşılaştırması
| Thomson Atom Teorisi | Modern Atom Teorisi |
|---|---|
| Atomlar yaklaşık 10^(-10) m çapında içi dolu kürelerdir. | Atomlar yaklaşık 10^(-10) m çapında olan boşluklu yapılardır. |
| Küre içerisinde (atomda) artı yükler ve eksi yüklü elektronlar rastgele dağılmıştır. | Elektronlar rastgele değil belirli bir yörüngede hareket eder. |
| Atomda pozitif ve negatif yükler eşit sayıdadır. Bu nedenle atomlar yüksüzdür. | Elektronlar ve protonlar eşit sayıda olmayabilir. Bu nedenle atom yüklü olabilir. |
| Elektronların kütlesi atomun kütlesi yanında ihmal edilecek kadar küçüktür. Atomun kütlesi pozitif yüklerle oluşur. | Atomun içinde sadece elektron ve proton yoktur. |
C) Rutherford Atom Modeli
Rutherford Atom Modeli, Rutherford’un alfa tanecikleri deneyleri sonucunda geliştirdiği bir atom modelidir. 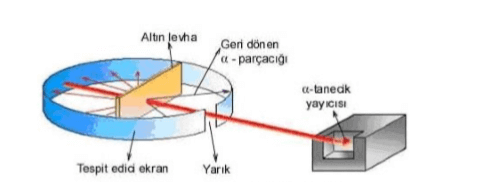
modele göre:
- Atomun kütlesi ve artı yükleri, atomun merkezinde çok küçük bir hacme toplanmıştır. Bu küçük bölüme “atom çekirdeği” adı verilir.
- Bir atomda çekirdekteki pozitif yük miktarı, elektron sayısına eşittir.
- Çekirdekteki pozitif yük miktarı, bir elementin tüm atomlarında aynıdır, ancak farklı elementlerin atomlarında farklıdır.
- Elektronların bulunduğu hacim, çekirdeğin hacminden çok daha büyüktür.
Rutherford Atom Modeli, genellikle güneş sistemi ile benzetilir, çünkü çekirdek merkezde bulunur ve etrafında elektronlar belirli yörüngelerde dönerler.
Ancak Rutherford Atom Modeli’nin eksiklikleri de vardır:
- Rutherford modeli, atomdaki elektronların hareketlerini ve enerji seviyelerini açıklayamaz. Özellikle, elektronların neden çekirdek üzerine düşmediği sorusu bu modele cevap verilemeyen bir sorundur.
- Rutherford’un modeli, atom çekirdeğinin içinde nötron adı verilen yüksüz bir parçacığın varlığını bilmemektedir. Bu, atomun üç temel parçacıktan oluştuğu gerçeğini göz ardı etmektedir.
Daha sonraki yıllarda James Chadwick tarafından yapılan çalışmalarla atom çekirdeğindeki nötronların varlığı saptanmış, bu sayede atomun daha ayrıntılı bir yapısı anlaşılmıştır. Bu gelişmeler, Modern Atom Teorisi’nin temellerini atmıştır.
Rutherford Atom Modeli ile Modern Atom Teorisi Karşılaştırması
| Rutherford Atom Teorisi | Modern Atom Teorisi |
|---|---|
| Atomda çekirdek adı verilen yapı vardır. | Atom kütlesinin büyük bir kısmı çekirdekten oluşur. |
| Atom, pozitif yüklü çekirdek ve onun çevresinde çembersel yörüngelerde dolanan negatif yüklü elektronlardan oluşur. Çekirden atomun kütlesinn çoğunluğunu oluşturur. | Atomun içinde çekirdek ve çekirdeğin etrafında elektronların bulunma ihtimalinin yüksel olduğu yerler vardır. |
| Atomun büyük kısmı boşluklu yapıdadır ve elektronlar çekirdek çevresindeki bu boşluklarda hareket etmektedir. | Atomun büyük kısmı boşluktan oluşur. |
| Eğer elektronlar durgun halde olsaydı çekirdekteki pozitif yükler ile elektronlar arasında oluşan elektrostatik çekimden dolayı elektronlar çekirdek üzerine düşerdi. | Elektron, çekirdek çevresinde belirli yörüngelerde çekirdeğe düşmeden hareket eder. |
D) Bohr Atom Modeli
Rutherford atom modeli, çekirdek çevresinde dönen elektronların hareketlerini fizik yasalarına göre yetersiz açıklamaktadır. Bu eksikliklerin farkına varan Danimarkalı fizikçi Bohr, tek elektronlu atomlar veya iyonlar için geçerli olan yeni bir atom modeli geliştirmiştir. Bohr atom modelinin temel varsayımları şunlardır:
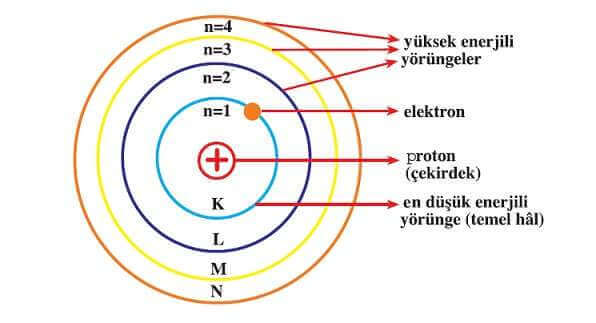
- Elektronlar, çekirdek çevresinde belirli yarıçaplı dairesel yörüngelerde bulunabilirler. Bu yörüngelere enerji düzeyi denir ve harfle (K, L, M…) veya tam sayılarla (1, 2, 3, …n) gösterilir. Her enerji düzeyinin belirli bir enerjisi vardır.
- Çekirdeğe en yakın enerji düzeyinin enerjisi en düşüktür. Yörüngeler çekirdekten uzaklaştıkça enerjileri artar. Hidrojen atomunda, bir elektron en düşük enerjili yörüngede bulunur. Elektronlar, enerji vermedikçe bu düşük enerjili yörüngede kendiliğinden bulunurlar. Bu yörüngelerde bulunan elektronların düzenlenmesine temel hâl elektron dizilimi denir. Eğer atom dışarıdan enerji alırsa, elektronlar daha yüksek enerjili yörüngelere geçebilirler. Bu durumda elektronlara uyarılmış elektronlar veya atomlara uyarılmış atomlar denir.
Ancak Bohr atom modeli de kendi eksikliklerine sahiptir:
- Bohr modeli yalnızca tek elektronlu sistemlerin spektrumlarını açıklayabilir. Çok elektronlu sistemlerin spektrumlarını yeterince açıklayamaz.
- Çok elektronlu atomların spektrumlarında enerji düzeylerinin her birinin iki veya daha fazla alt düzeye ayrıldığı gözlemlenir. Bu durum, Bohr’un teorisiyle açıklanamaz.
Modern Atom Modeli (Kuantum Atom Teorisi), ışığın hem dalga hem de tanecik özelliklerini içeren karma bir yapıya sahip olduğu ve elektron gibi küçük parçacıkların da dalga özellikleri sergileyebileceği fikri üzerine inşa edilmiştir. Bu modelin gelişim sürecinde önemli gelişmeler şunlar olmuştur:
- W. Pauli’nin Pauli İlkesi (1924): Pauli, elektronların enerji seviyelerine (katmanlara) dağılışları ve enerji seviyeleri arasındaki elektron geçişleri hakkında Pauli İlkesini ortaya koymuştur. Bu ilkeye göre aynı enerji seviyesindeki elektronlar, dönüşümsüz olarak aynı kuantum sayılarına sahip olamazlar. Bu ilke çok elektronlu atomların davranışlarının anlaşılmasına katkı sağlamıştır.
- James Chadwick’in Nötronun Keşfi (1932): James Chadwick, atom çekirdeğindeki nötronları keşfetmiştir. Bu keşif, atom çekirdeğinin daha fazla anlaşılmasına yardımcı olmuştur.
- Heisenberg Belirsizlik İlkesi (1927): Werner Heisenberg, atomdaki elektronların aynı anda hem pozisyonlarını hem de momentumlarını tam olarak belirlemenin imkansız olduğunu belirten belirsizlik ilkesini geliştirmiştir. Bu ilke, atomdaki parçacıkların hareketlerinin sınırlarını açıklamıştır.
- Schrödinger Denklemi (1926): Erwin Schrödinger, kendi adını taşıyan denklemde elektronların olasılık dağılımını inceleyerek, elektronların bulunma ihtimallerinin yüksek olduğu uzay bölgelerini hesaplamıştır. Bu, elektronların hareketlerini daha ayrıntılı bir şekilde açıklamaya yardımcı olmuştur.
Modern Atom Modeli’nin temel varsayımları şunlardır:
- Elektronlar, belirli enerji seviyelerinde bulunur ve her enerji seviyesi baş kuantum sayısı (n) ile belirtilir. Enerji seviyeleri, çekirdekten uzaklaştıkça enerji artar.
- Elektronlar hem kendi ekseni etrafında döner (spin hareketi) hem de çekirdek çevresinde orbital hareketi yaparlar. Orbital, elektronların bulunma ihtimalinin yüksek olduğu geometrik bölgeleri ifade eder.
- Her temel enerji seviyesinde n² kadar orbital bulunur.
- Her temel enerji seviyesindeki orbital sayısının 2 katı kadar elektron bulunabilir (Pauli İlkesi).
Bu gelişmeler sayesinde modern atom teorisi, atomların yapılarını ve davranışlarını daha ayrıntılı bir şekilde açıklamıştır. Aynı zamanda ışığın hem dalga hem de tanecik özelliklerini içeren dalga-tanecik ikiliği de çözümlenmiştir.
De Broglie’nin, Heisenberg’in ve Erwin Schrödinger’in çalışmaları sayesinde atomun kuantum modeli geliştirilmiştir.